-
Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题。
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为_________________;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO·Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为__________;
PbO也是一种重要的物质。工业上生产锌钡白(ZnS·BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下。
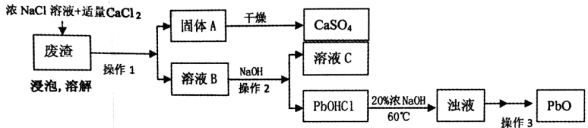
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq) PbCl2(s)+SO42-(aq)
PbCl2(s)+SO42-(aq)
溶【解析】
PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
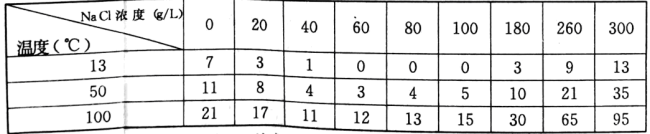
(3)浸泡溶解时采用95℃的高温,其主要目的有_____________(答两条);
(4)溶液C中的溶质主要成份是___________,在实验室里,将溶质分离出来需要用到的玻璃仪器有__________;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为__________(用百分数表示,精确到小数点后一位)。
-
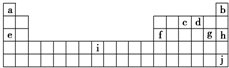
下表是元素周期表的一部分,表中所列字母分别代表十种化学元素,就表中字母所代表的元素回答下列问题.
(1)铅(原子序数为82)从单质到其化合物都有着广泛的应用,如制造焊锡、铅蓄电池、化工耐酸设备以及X射线的防护材料等.铅的氧化物主要有三种:PbO、PbO2和Pb3O4.请回答下列问题:
①铅位于元素周期表中第______周期第______族;
②PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应的离子方程式:______.
(2)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图______.
(3)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑.请预测首先被用来与F2反应制备稀有气体化合物的元素是______(填写字母).利用稀有气体化合物,人们实现了许多制备实验上的突破.如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式______ 3NaBrO4+Xe
-
(10分)金属铅为带蓝色的银白色重金属,其单质及化合物可用于铅蓄电池、耐酸设备及X射线防护材料。回答下列问题:
(1)铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O。写出放电时负极的电极反应式 。
2PbSO4+2H2O。写出放电时负极的电极反应式 。
(2)早在古代,硫酸铅就被用作白色颜料,但用这种颜料作出的画天长日久会变为黑色,经检测其成分为PbS。古画修复师在变黑处涂抹H2O2后即可将颜色修复,用化学方程式表示古画修复颜色的原理 。
(3)PbO与次氯酸钠溶液反应可以制得PbO2,写出该反应的离子方程式 。
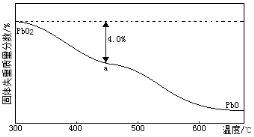
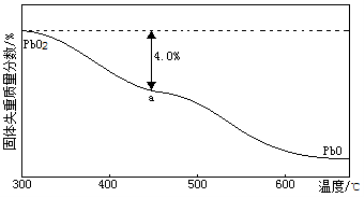
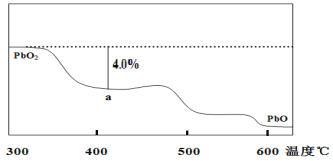
(4)PbO2在加热过程中发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x= ,m:n= 。
)的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x= ,m:n= 。
-
(12分).铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,
PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _。若电解液中不加入Cu(NO3)2,主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
-
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为第 周期、第 族,PbO2的酸性比CO2的酸性 (填“强”“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;Pb O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的
O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的 电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
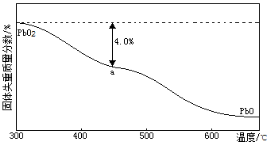
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
-
铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 ① 周期,第 ② 族:PbO2的酸性比CO2的酸性 ③ (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 ④ 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ⑤ ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式
⑥ ,阴极观察到的现象是 ⑦ ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式 ⑧ ,这样做的主要缺点是 ⑨ 。
-
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,四氧化三铁可写成FeO·Fe2O3 的形式,如果将Pb3O4也写成相对应的形式应为: 。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
PbO2可有PbO与次氯酸钠溶液反应制得,其反应的离子方程式为 。
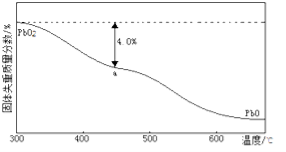
(3)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即 )的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
)的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
-
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为______ ____,Fe3O4可写成FeO·Fe2O3的形式,如果将Pb3O4也写成相对应的形式应为:______________
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________。PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为______________。
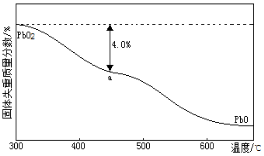
(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________,____________。
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________,____________。
-
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___?
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%((即样品起始质量—a点固体质量)/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___、___。
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1) 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁 Ⅲ
Ⅲ ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___ 碳原子为____杂化,
碳原子为____杂化, 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中 键
键 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇 属于____晶体.
属于____晶体. 存在的化学键有_____
存在的化学键有_____ 填字母
填字母 .
.
A.离子键  极性键
极性键  非极性键
非极性键  配位键
配位键  氢键
氢键  金属键
金属键
(4)已知: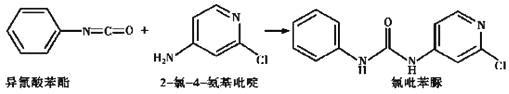 ,反应后,
,反应后, 键_____,
键_____, 键_____
键_____ 填“增加”或“减少”
填“增加”或“减少” .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成 ,则
,则
 咪唑
咪唑 中的“离域
中的“离域 键”可表示为_________
键”可表示为_________
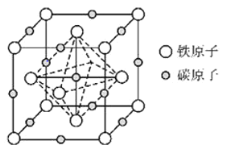
(6)奥氏体是碳溶解在 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为 ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______ 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 .
.

PbCl2(s)+SO42-(aq)


 )的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x=
)的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x=
 )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_
 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_
 )的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n
)的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n 


 ,反应后,
,反应后,