-
(15 分)二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g) +CO(g)  CH3OH(g) ΔH= —90.0 kJ· mol-1 ①
CH3OH(g) ΔH= —90.0 kJ· mol-1 ①
2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=—24.5 kJ· mol-1 ②
CH3OCH3(g) + H2O(g) ΔH=—24.5 kJ· mol-1 ②
CO(g) + H2O(g) CO2(g) + H2(g) ΔH=—41.1 kJ· mol -1 ③
CO2(g) + H2(g) ΔH=—41.1 kJ· mol -1 ③
(1)反应①的 ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在 250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是_______(填选项字母)
A.容器内气体密度保持不变
B.CO 与 CO2 的物质的量之比保持不变
C.H2O 与 CO2 的生成速率之比为 1∶1
D.该反应的平衡常数保持不变
(3)已知一些共价键的键能如下:
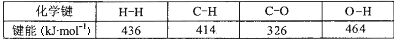
运用反应①计算一氧化碳中碳氧共价键的键能 kJ· mol-1。
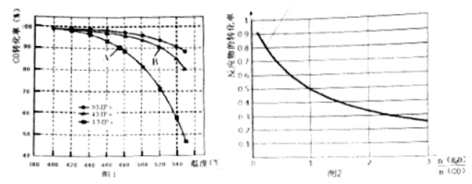
(4)当合成气中 CO 与 H2 的物质的量之比恒定时,温度、压强对 CO 转化率的影响如图 1 所示。图 1 中 A 点的 v(逆) B 点的 v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为 500℃、4MPa 请回答采用 500℃的可能原因 。
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与 n(H2O)∕n(CO)的关系如图2所示。计算该温度下反应③的平衡常数 K= 。
在图 2 中作出一氧化碳的转化率与 n(H2O)∕n(CO)的曲线。
-
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=-90.0 kJ·mol-1①
CH3OH(g) ΔH=-90.0 kJ·mol-1①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1②
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1③
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1③
(1)下列说法正确的是________(填字母)。
A.反应①的ΔS<0、ΔH<0,所以能在较低温度下自发进行
B.反应③的H2O与CO的生成速率之比为1∶1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式 :_______________,电池总反应离子方程式:___________________。
:_______________,电池总反应离子方程式:___________________。
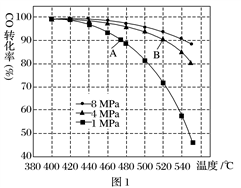
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)________(填“>”“<”或“=”)B点的v(正),说明理由_____________________________________。
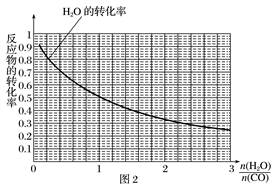
(4)一定温度下,密闭容器中发生反应③,该反应的平衡常数表达式K=________________________;水蒸气的转化率与 的关系如图2,计算该温度下反应③的平衡常数K=______。在图2中作出一氧化碳的转化率与
的关系如图2,计算该温度下反应③的平衡常数K=______。在图2中作出一氧化碳的转化率与 的曲线。_________________________
的曲线。_________________________
-
CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:

①p1、p2、p3中最大的是________。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____mol·L-1·min-1。
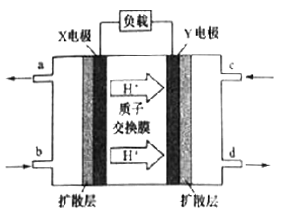
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______(填“减弱”、“增强”或“不变”),Y电极是_____极,写出X电极上发生的电极反应式__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____L(标准状况下)
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______ CO+H2
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______ CO+H2
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______ CO+H2
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______ CO+H2
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______ CO+H2
-
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g) ΔH<0
CH3OCH3(g)+CO2(g) ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 b.加入催化剂
c.缩小容器体积 d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO) b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变 d.混合气体的平均相对分子质量不变
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
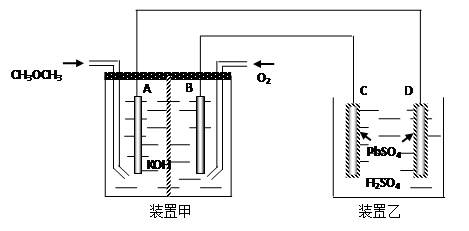
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。
-
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:

① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K (填“增大”、“减小”或“不变”)
CH3OH(g) ΔH=-90.0 kJ·mol-1①
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1②
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1③
:_______________,电池总反应离子方程式:___________________。
的关系如图2,计算该温度下反应③的平衡常数K=______。在图2中作出一氧化碳的转化率与
的曲线。_________________________







