-
(15分)请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 。
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 。简述你的判断依据
。
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体。
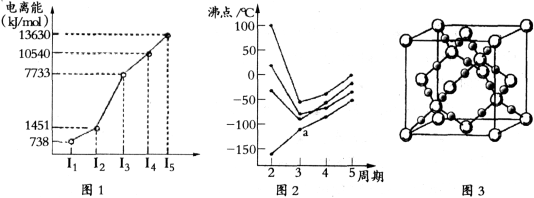
(4)BCl3原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有
种。写出与BCl3结构相同的一种等电子体(写离子) 。
(5)Cu元素形成的单质,其晶体的堆积模型为______ ,D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是________ (填选项序号)。
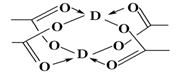
①极性键 ②非极性键 ③配位键 ④金属键
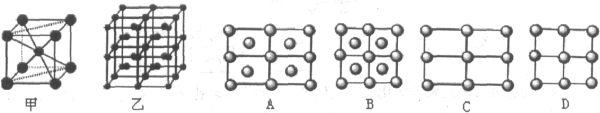
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。
-
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。

(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。

(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。

(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
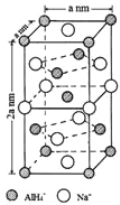
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
-
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。

(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。

a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。
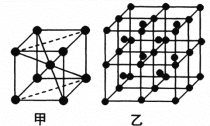

铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
-
下表为周期表的一部分,其中的编号代表对应位置的元素。
请回答下列问题:
(1)写出上表中元素⑨原子的核外电子排布式________。
(2)元素④、⑤的第一电离能大小顺序是:________>________ ;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是:________>________
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:________,分子的空间构型________
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢
氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式________
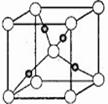
(5)下图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为________。
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。
已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:________
-
第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):
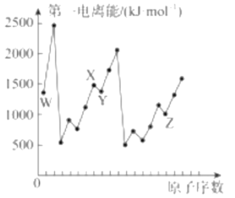
(1)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________。
(2)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________。
(3)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
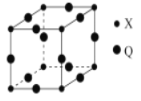
Q原子周围距其距离最近的Q原子的数目为_______(阿拉伯数字表示)。
(4)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________(用含π的式子表示)。
-
如图为周期表的一部分,其中的编号代表对应位置的元素.请回答下列问题:
(1)写出表中元素⑨原子的核外电子排布式______.
(2)元素④、⑤的第一电离能大小顺序是:______>______;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是:______>______
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:______,分子的空间构型______
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的化学方程式______
(5)如图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为______.
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:______.
-
W、X、Y、Z 四种元素原子序数依次减小。已知W的原子序数为29;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能数据如下表;Z原子价电子排布式为nsnnpn。请回答下列问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
(1)W基态原子的电子排布式为________。
(2)电负性:X________Y(填“>”、“=”或“<”)。
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物高,原因是________。
(4)Z2X4中,Z原子采用________杂化,每个分子中含有________个σ键,________个π键。
(5)已知W2+能与氨分子形成配离子[W(NH3)4]2+,该配离子中存在的化学键有________。(填标号)
A.金属键 B.离子键 C.共价键 D.配位键
-
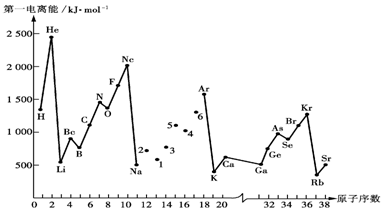
(10分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是 ________
________。
(3)上图中6号元素在周期表中的位置是 ________;
其原子M层电子的轨道表示式为________。
(4)上图中4,5,6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:________。
-
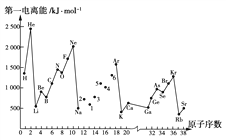
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图象________。
(2)从上图分析可知,同一主族元素原子的第一电离能I1的变化规律是_________。
(3)上图中5号元素在周期表中的位置是_________________________________。
(4)上图中4、5、6号三种元素的气态氢化物的化学式分别为__________________。
(5)上图中1~6号元素中,最高价氧化物对应水化物中酸性最强的是_______,两性化合物有______。
-
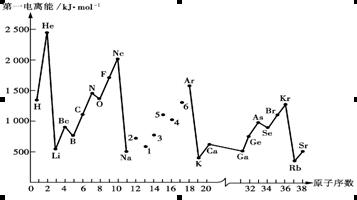
(12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________

















