-
软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:
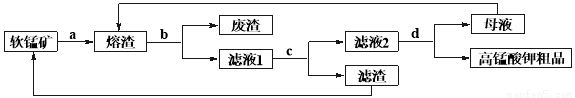
A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
-
(15分)软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:

a.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30 min,冷却得墨绿色熔渣(主要成分为K2MnO4);
b.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
c.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是: 。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
-
KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是_____。
(2)Ⅰ中,生成K2MnO4的化学方程式是_____。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_____。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如图:
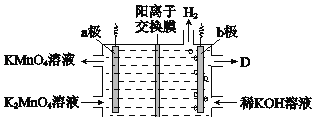
①b极是_____极(填“阳”或“阴”),D是____________。
②结合电极反应式简述生成KMnO4的原理:___________。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是__________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 ═H2C2O4 +Na2SO4
5H2C2O4 +2MnO4﹣+6H+═2Mn2++10CO2↑+8H2O
摩尔质量:Na2C2O4 134g/mol KMnO4 158g/mol
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为_________。
-
工业上以软锰矿(主要成分为MnO2) 为主要原料制备高锰酸钾(KMnO4)的工艺流程如下:

回答下列问题:
(1)原料软锰矿在使用之前通常需粉碎,其目的是_________________________________。
(2)“烘炒”时是将混合物放入某种材质的坩埚内,混合均匀,小火加热至熔融,有K2MnO4和KCl生成,则烘炒过程中发生反应的化学方程式为________________;“烘炒”时所用坩埚的材质可以选用_______(填字母)。
a.石英 b.氧化铝 c.硅酸盐陶瓷 d.铁
(3)已知水溶过程中无化学反应发生,通入CO2使反应体系呈中性或弱酸性即可发生歧化反应,则歧化时发生反应的氧化产物与还原产物的物质的量之比为_______________。
(4)对滤液进行蒸发浓缩时,温度不宜超过60℃,其原因是_________________;将蒸发温度控制在60℃左右的最佳操作方法是_______________________。
(5)流程中可以循环利用的物质是___________________。
(6)用CO2歧化法将K2MnO4转化为KMnO4属于传统工艺,现代工艺多采用电解法,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为_________________;与“CO2歧化法”相比,“电解法”的显著优点是____________________。
-
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌.待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入.随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min.
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解.趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液.
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图1所示进行电解.阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝.接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极.在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率.
回答下列问题:
(1)步骤①发生的反应方程式为______ 3K2MnO4+KCl+3H2O
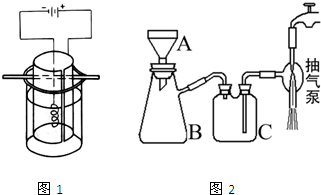
-
某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后加热熔融可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体(粗产品)。
请回答下列问题:
(1)步骤一加热熔融应在________(填序号)进行。
A.铁坩埚 B.氧化铝坩埚 C.瓷坩埚 D.石英
(2)为进一步提高粗产品(高锰酸钾晶体)的纯度,常采用的实验方法是_____________。
(3)KMnO4、MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等物质的量的氯气消耗KMnO4与MnO2的物质的量之比为________________。
(4)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡),记录的现象如表:
| 滴入KMnO4溶液的次序(假设每滴溶液体积相等) | 滴入的KMnO4溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因:_________。
(5)我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。我校某同学通过查阅资料,拟采用如下方法测定2019年暑假新装修的焕然一新的明德楼教室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O。
实验操作:用容积为1000mL用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如图),当酸性高锰酸钾溶液正好褪色时,停止注入。
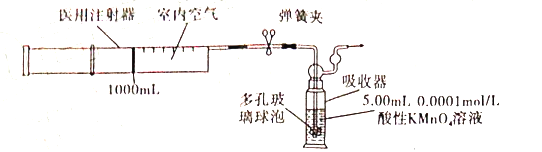
①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液l000mL,需0.1000mol/L的酸性KMnO4溶液的体积为___________。
②装置中多孔玻璃球泡的作用是__________。
③该同学在206教室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第250次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液恰好褪色。请通过计算判断,该教室空气中甲醛含量________(填“已”或“未”)超标。若未超标,该教室内空气中甲醛(HCHO)含量为________mg/m3;若已超标,请举出减少室内空气污染的一条合理措施:_________________。
-
某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
| K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
| KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。
-
高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分为MnO2)为原料制备高锰酸钾。其部分流程如下:
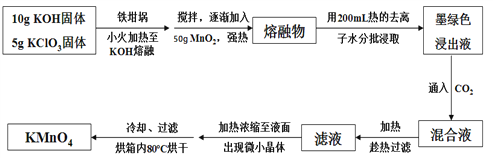
已知:墨绿色浸出液的成分为K2MnO4、KCl溶液
回答下列问题:
(1)实验中采用铁坩埚而不是瓷坩埚的原因是:(用化学反应方程式表示)___________________________________________________。
(2)写出生成K2MnO4和KCl反应的化学方程式:________________________;通入CO2,可使MnO42-发生反应,生成MnO 及MnO2。若通入CO2太多,则在加热浓缩时,会有__________________晶体和KMnO4晶体一起析出。
及MnO2。若通入CO2太多,则在加热浓缩时,会有__________________晶体和KMnO4晶体一起析出。
(3)在加热、浓缩、烘干的过程中温度不宜过高,其原因是(用化学反应方程式表示)_________________________;过滤用到的玻璃仪器有烧杯、_________、_______;加热时用玻璃棒不断搅拌溶液的目的是_______________________________________;洗涤KMnO4晶体用冷水洗涤较好的原因是_______________________________________。
(4)计算12.25 g KClO3固体经过上述转化,最多可制得KMnO4的质量为___________(结果保留一位小数)。(相对原子质量:K—39 Cl—35.5 O—16 Mn—55)
-
(12分)近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其部分流程如下:
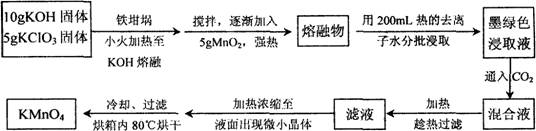
(1)实验中采用铁坩埚而不用瓷坩埚的原因是________;
(2)KOH、KClO3、MnO2共熔制得绿色K2MnO4的化学方程式________;
(3)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,则K2MnO4完成反应时,转化为KMnO4的百分率约________(精确至0.1%)
(4)若通入CO2太多,则在加热浓缩时,会有________晶体和KMnO4晶体一起析出。
(5)在加热、浓缩、烘干的过程中温度不宜过高,其原因是________;加热时用玻璃棒不停搅拌溶液的目的是。
-
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3 在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是________。
(2)K2MnO4制备KMnO4的离子方程式是________。
(3)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(4)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16.00 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为_____。







