-
铜及其化合物在工农业生产及日常生活中应用非常广泛。回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。
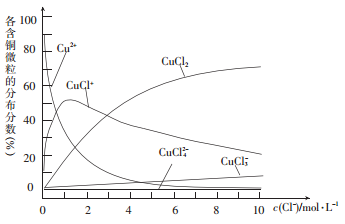
① 当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)= l mol /L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
-
纳米级Cu2O由于具有优良的催化性能而受到科学家的不断关注,下列为制取Cu2O的三种方法:
| 方法Ⅰ | 用碳粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,原理为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_________________________ 。
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________ ;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过离子交换膜的阴离子的物质的量为________mol。(离子交换膜只允许OH-通过)
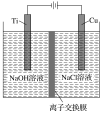
(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为________________。
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:___________________________。
-
(1) 纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s)+ O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
C(s)+  O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)===2 CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
________。
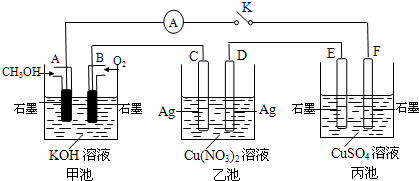
(2)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
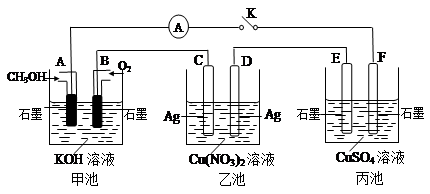
请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为________。
(2)丙池中F电极为________ (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为________。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是________(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
-
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
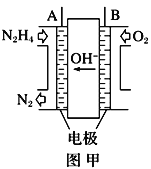
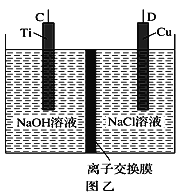
①上述装置中D电极应连接肼燃料电池的____极(填“A”或“B”),该电解池中离子交换膜为_____离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为____________
③当反应生成14.4 g Cu2O时,至少需要肼________ mol。
(2)利用下图丙装置,可以模拟铁的电化学防护。
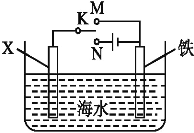
若X为碳棒,为减缓铁的腐蚀,开关K应置于_______处。若X为锌,开关K置于M处,该电化学防护法称为_________。
-
纳米级 Cu2O 由于具有优良的催化性能而受到关注,下表为制取 Cu2O 的四种方法:
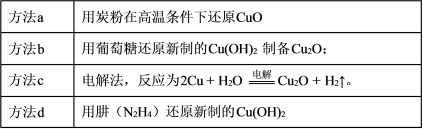
(1)已知:①2Cu(s)+ O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+ O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+ O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法 a 发生的热化学方程式是:__________________________。
(2)方法 c 采用离子交换膜电解法控制电解液中 OH-的浓度而制备纳米 Cu2O,装置如图所示:

上述装置中 A 电极应连_____电极(填“C”或“D”)
②该离子交换膜为_____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为: _____,钛极附近的 pH 值_____(填“增大”“减小”或“不变”)。
③原电池中 OH-移动方向是向_____(填“左”或“右”)移动,原电池中负极反应式为:_____
(3)在相同的密闭容器中,用以上方法制得的三种 Cu2O 分别进行催化分解水的实验:
2H2O(g)  2H2(g)+O2(g) △H>0。水蒸气的浓度随时间 t 变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气的浓度随时间 t 变化如下表所示:
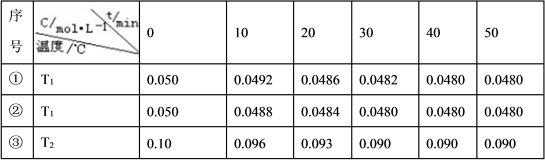
①对比实验的温度:T2_____T1(填“﹥”“﹤”或“﹦”);实验①、②、③的化学平衡常数 K1、K2、K3 的大小关系为:_____
②实验①前 20 min 的平均反应速率 v(O2)=_____
③催化剂的催化效率:实验①_____实验②(填“﹥”或“﹤”)。
-
(1)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+ O2(g)═Cu2O(s)△H=-169kJ•mol-1,
O2(g)═Cu2O(s)△H=-169kJ•mol-1,
C(s)+ O2(g)═CO(g)△H=-110.5kJ•mol-1,
O2(g)═CO(g)△H=-110.5kJ•mol-1,
2Cu(s)+O2(g)═CuO(s)△H=-314kJ•mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为______.
(2)某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.
请回答下列问题:
(1)甲池为______(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______.
(2)丙池中F电极为______ (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为______ 2H2SO4+2Cu+O2↑
-
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu (s)+½O2(g) =Cu2O(s) △H=-a kJ·mol-1
C (s)+½O2(g) =CO (g) △H=-b kJ·mol-1
Cu (s)+½O2(g) =CuO (s) △H=-c kJ·mol-1
则方法I发生的反应:2CuO(s) +C(s) =Cu2O(s)+CO(g);△H__________kJ·mol-1
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:__________________。
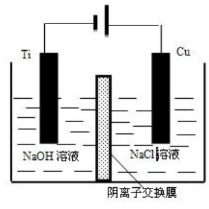
(3)方法II为加热条件下用液态肼(N2H4)逐原新制Cu (OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为____________________。
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式并说明该装置制备Cu2O的原理________________________。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)  2H2(g) + O2(g) △H>O,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示
2H2(g) + O2(g) △H>O,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示
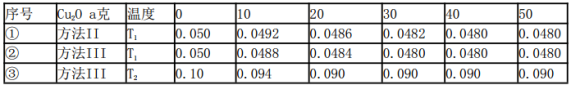
下列叙述正确的是_________(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10- 5mol/(L·min)
c.实验②比实验①所用的Cu2O催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3
-
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法的反应为2Cu+H2O  Cu2O+H2↑ Cu2O+H2↑ |
(1)已知:2Cu(s) + 1/2 O2(g) = Cu2O(s) △H = -169KJ/mol
C(s) +1/2 O2(g) = CO(g) △H= -110.5kJ/mol
Cu(s) + 1/2 O2(g) = CuO(s) △H = -157kJ/mol
则方法Ⅰ反应的热化学方程式为______________________ 。
(2)方法Ⅱ采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
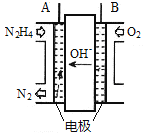
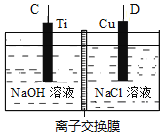
图甲 图乙
①上述装置中D电极应连接肼燃料电池的_______极(填“A”或“B”),该电解池中离子交换膜为______离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为_______________________________,肼燃料电池中A极发生的电极反应为___________________________________。
③当反应生成14.4 g Cu2O时,至少需要肼______mol。
-
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为 钛极附近的pH值 (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: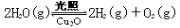 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。
| 序号 | 
| 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母)。
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
-
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)已知:2Cu(s)+ O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
O2(g)=Cu2O(s)△H=﹣akJ•mol﹣1
C(s)+ O2(g)=CO(g)△H=﹣bkJ•mol﹣1
O2(g)=CO(g)△H=﹣bkJ•mol﹣1
Cu(s)+ O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
O2(g)=CuO(s)△H=﹣ckJ•mol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJ•mol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .
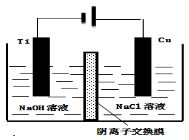
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)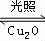 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5mol•L﹣1•min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.







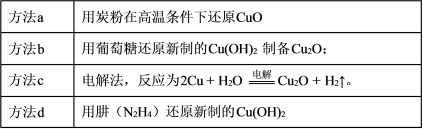

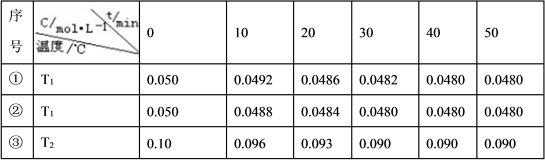







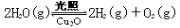 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。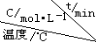

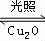 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)