-
工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是____________________________________ 。
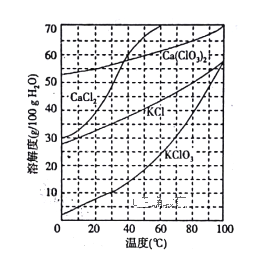
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。
-
工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
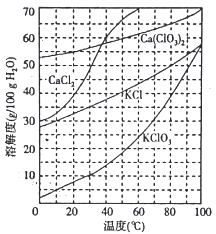
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。
-
工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
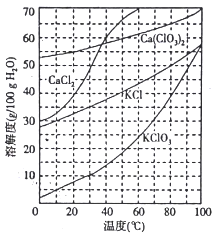
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。
-
工业上制取氯酸钾的主要步骤为:
I.将C12通入石灰浆,充分反应后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
步骤I存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
(1)①标出反应6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 中电子转移的方向和数目
② 滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]___________l:5(填“>”、“<”或“=”),理由是___________ 。(请用有关反应和必要的文字进行说明)
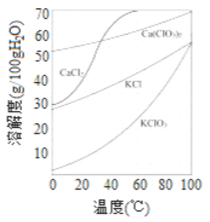
(2)上图是有关物质的溶解度曲线. 步骤II中,若溶液中KClO3的含量为100g·L-1,从该 溶液中尽可能多地析出KClO3 固体的方法是______________。
溶液中尽可能多地析出KClO3 固体的方法是______________。
-
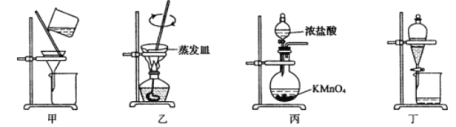
实验室从废定影液中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示。下列叙述正确的是
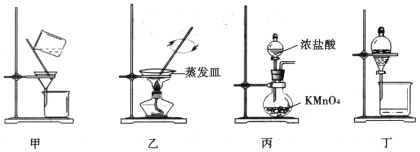
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag
C.用装置丙制备Cl2,其中KMnO4也可用MnO2代替
D.用装置丁分液时,打开分液漏斗塞子,再打开旋塞,使下层液体从分液漏斗下端放出,待两液界面与旋塞上口相切即可关闭旋塞
-
废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌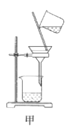
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag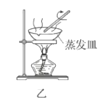
C.用装置丙制备Cl2 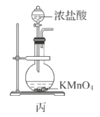
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层
-
实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
-
实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;制取Cl2并通入滤液氧化Br-,用苯萃取分液。其中部分操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌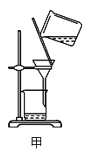
B.用装置乙在空气中高温灼烧Ag2S制取Ag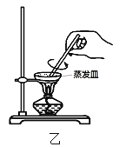
C.用装置丙制备用于氧化滤液中Br-的Cl2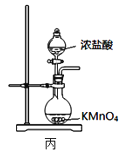
D.用装置丁分液时,先放出水相再放出有机相
-
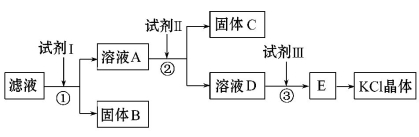
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。
回答下列问题:
(1)试剂Ⅰ的化学式为 ,①中发生反应的离子方程式为________
。
(2)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 。
(3)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 。
(4)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用硝酸银溶液反应共消耗硝酸银0.002 562 mol,则该产品的纯度为________
。
-
某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
| K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
| KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。














