-
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJ•mol﹣1,F﹣F键能159kJ•mol﹣1,Cl﹣Cl键的键能为242kJ•mol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJ•mol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
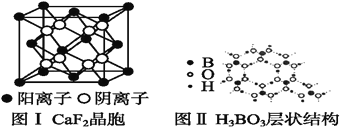
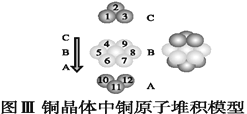
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
-
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
-
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是__________________________(用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为_________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
-
氟在自然界中常以CaF2的形式存在。
(1)下列有关CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_________________________________(用离子方程式表示)。
已知:AlF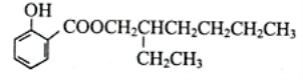 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子中存在的化学键类型________,OF2的电子式________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1 。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
-
氟在自然界中常以CaF2的形式存在。下列关于CaF2的表述不正确的是
A. CaF2晶体中Ca2+与F-的配位数之比为2:1
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
-
下列关于CaF2的表述正确的是
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在晶体状态下能导电
-
氟在自然界中常以CaF2的形式存在。下列关于CaF2的表述正确的是( )
A.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
B.F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D.Ca2+与F-间只存在静电吸引
-
关于化学键的下列叙述中,正确的是( )
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物可能含共价键 ⑥共价化合物可能含离子键
⑦离子化合物只含离子键 ⑧共价化合物不含离子键
A.②③④⑦ B.②③⑤⑧ C.②④⑤⑥ D.①③⑤⑧
-
下列有关说法不正确的是( )
A.水合铜离子的模型如图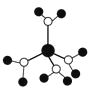 ,该微粒中存在极性共价键、配位键
,该微粒中存在极性共价键、配位键
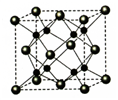
B.CaF2晶体的晶胞如图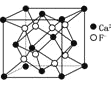 ,距离F-最近的Ca2+组成正四面体
,距离F-最近的Ca2+组成正四面体
C.氢原子的电子云图如图 ,氢原子核外大多数电子在原子核附近运动
,氢原子核外大多数电子在原子核附近运动
D.金属Cu中Cu原子堆积模型如图 ,为面心立方最密堆积,Cu原子的配位数均为12
,为面心立方最密堆积,Cu原子的配位数均为12
-
下列说法错误的是( )
A. 离子晶体中阴阳离子间的作用力为静电引力
B. 离子键没有方向性和饱和性
C. 在氯化铯晶体中无CsCl分子单独存在
D. CaF2晶胞中F-的配位数为4


 在溶液中可稳定存在。
在溶液中可稳定存在。
 ,该微粒中存在极性共价键、配位键
,该微粒中存在极性共价键、配位键 ,距离F-最近的Ca2+组成正四面体
,距离F-最近的Ca2+组成正四面体 ,氢原子核外大多数电子在原子核附近运动
,氢原子核外大多数电子在原子核附近运动 ,为面心立方最密堆积,Cu原子的配位数均为12
,为面心立方最密堆积,Cu原子的配位数均为12