-
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P 4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为_______________。
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能:P—P 198 kJ·mol-1,Cl—Cl 243 kJ·mol-1,P—Cl 331 kJ·mol-1。则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。

-
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+ O2(g)===
O2(g)=== P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
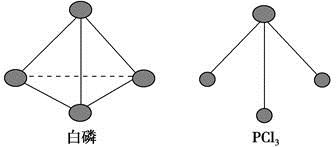
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
-
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+ O2(g)===
O2(g)===  P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能
(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=________。
-
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,红磷)+ O2(g)=
O2(g)= P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
-
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应的能量变化如图所示。下列说法正确的是
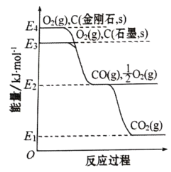
A.在通常状况下,金刚石比石墨更稳定
B.石墨的燃烧热为
C.

D.12g石墨在一定量的空气中燃烧,生成气体产物36g,该过程放出的热量为
-
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
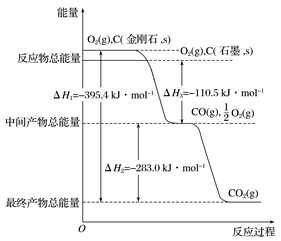
(1)在通常状况下,金刚石和石墨相比较,____________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________________。
(2)12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为_____。
-
在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s) + 5O2(g) = P4O10(s);ΔH=-3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s);ΔH =-2954.0 kJ·mol-1 由此判断下列说法正确的是
A.红磷的燃烧热为2954.0 kJ·mol-1
B.已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′
C.由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高
D.等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多
-
在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s) + 5O2(g) = P4O10(s);ΔH=-3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s);ΔH =-2954.0 kJ·mol-1
由此判断下列说法正确的是( )
A.红磷的燃烧热为2954.0 kJ·mol-1
B.已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′
C.由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高
D.等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多
-
在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s) + 5O2(g) = P4O10(s);ΔH=-3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s);ΔH =-2954.0 kJ·mol-1
由此判断下列说法正确的是( )
A.红磷的燃烧热为2954.0 kJ·mol-1
B.已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′
C.由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高
D.等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多
-
运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1 ,P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1 ,则白磷转化为红磷的热化学方程式为
P4O10(s) ΔH=-738.5kJ·mol-1 ,则白磷转化为红磷的热化学方程式为
A. P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1
B. P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1
C. P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1
D. P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1
O2(g)===
P4O10(s) ΔH2=-738.5 kJ·mol-1





