-
[化学--物质结构与性质]世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题:
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是____(填标号)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同-一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_____,Q2+的未成对电子数是_____.
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是______, [Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是_____,写出一种与SO42-互为等电子体的分子的化学式:_____________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_____________。
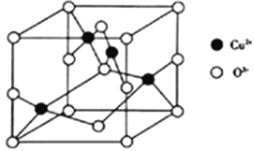
(4)CuO晶胞结构如图所示。

该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____ (用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。
(5)在Cu2O晶胞结构中,Cu处于正四面体空隙,O处于_____________。
-
(题文)世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______ (填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42-互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为pg.Cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含p的代数式表示,其中阿伏加德罗常数用NA表示)cm。

-
(题文)世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______ (填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42-互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为pg.Cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含p的代数式表示,其中阿伏加德罗常数用NA表示)cm。

-
世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S 三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______ (填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③ NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
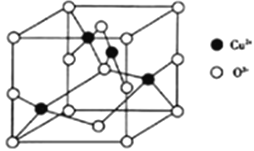
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。
-
世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S 三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______ (填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③ NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

-
世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S 三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______ (填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③ NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

-
世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S 三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______ (填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③ NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。
-
世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________ (填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______ (填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42- 互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为 ρ g·cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含 ρ 的代数式表示,其中阿伏加德罗常数用NA表示)cm。
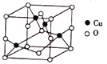
-
形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
(6)某离子晶体的晶胞结构如图所示。
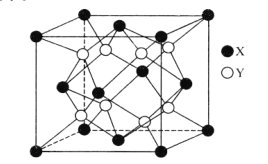
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。
-
形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为__。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为___。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
(5)某离子晶体的晶胞结构如图所示。
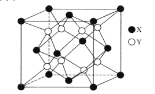
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。









