-
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
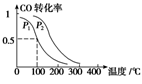
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
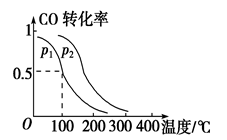
p2 p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g) CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g) CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g) CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
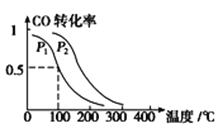
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。

-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g) CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g) CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g) CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。

-
(10分)运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.6kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.6kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.不断将CH3OH从反应混合物中分离出来 d.增大体系压强
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
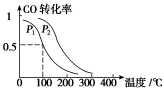
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
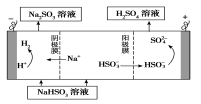
请写出开始时阳极反应的电极反应式________________。
-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
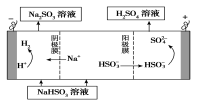
请写出开始时阳极反应的电极反应式________________。
-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
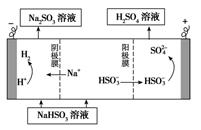
-
CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
回答下列问题:
(1)已知:H2和CH3OH的燃烧热分别为-285.8kJ·mol-1,-726.51kJ·mol-1;以及H2O(l)=H2O(g) △H=+44kJ·mol-1;则该反应的△H=________________;
(2)该反应的平衡常数表达式为________________;
(3)在350℃时,体积为0.5L的密闭容器中,充入1molCO2和3molH2发生上述反应,测定出CH3OH的体积分数随时间变化的曲线如图所示:
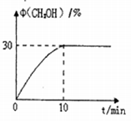
①能判断该反应达到化学平衡状态的依据是__________________;
A.容器内压强不变 B.H2的体积分数不变 C.c(CH3OH)=c(H2O) D.容器内密度不变
②氢气在0~10min的平衡反应速率v(H2)=_________________________;
③在右图中标出400℃时CH3OH的体积分数随时间变化的曲线。
(4)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气。试回答下列问题:
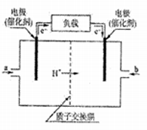
①这种电池放电时,b处通入______________,发生的电极反应方程式是_____________________。
②若电解液中的3molH+通过质子交换膜,则消耗甲醇__________L(标准状况)。
-
运用化学反应原理知识研究如何利用CO、 SO2等污染物有重要意义。
(1)用CO可以合成甲醇。
已知: ①CO的燃烧热△H1=-283kJ•mol-1
②N2(g)+O2(g)⇌ 2NO(g) △H2=+183kJ•mol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式________ 。
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2 ,在催化剂作用下发生反应:CO(g)+2H2(g)⇌ CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。
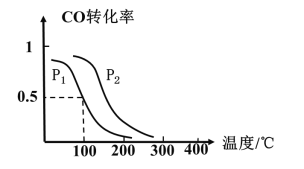
①反应的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是______ ,该反应的化学平衡常数K=____ 。
③下列说法正确的是______。
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
-
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
D.单位时间内,消耗2molH2的同时消耗1mol CH3OH
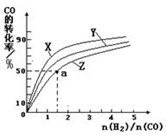
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是 ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K(写出计算过程)。
(2)已知: CO(g)+  O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+  O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) ⇌ CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) ⇌CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。
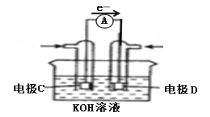
(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。















