-
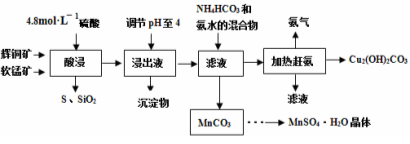
[化学——化学与技术](15分)辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(4)调节浸出液pH=4的作用是 。
(5)本工艺中可循环使用的物质是 (写化学式)。
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为 。
-
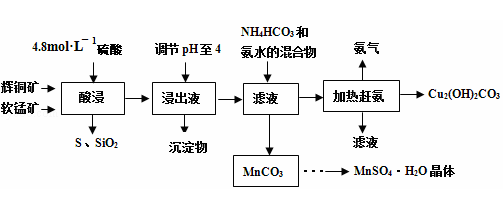
(14分)辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(4)调节浸出液pH=4的作用是 。
(5)本工艺中可循环使用的物质是 (写化学式)。
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为 。
-
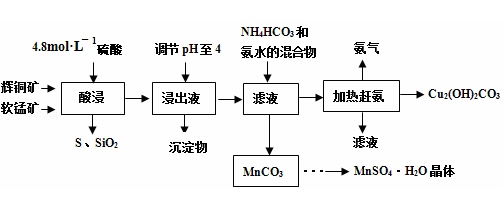
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(4)调节浸出液pH=4的作用是 。
(5)本工艺中可循环使用的物质是 (写化学式)。
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为 。
-
辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
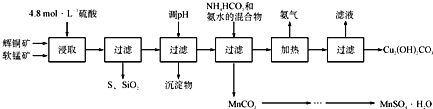
已知:
①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③MnSO4·H2O易溶于冷水,不溶于酒精;
④部分金属阳离子氢氧化物的(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算:当离子浓度小于1.0×10-5时,认为该离子沉淀完全。):
Ksp(Fe(OH)3)=1.0×10-38, Ksp(Cu(OH)2)=1.0×10-20, Ksp(Mn(OH)2)=4.0×10-14
(1)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式_________________________________。
(2)调pH的范围为____________。
(3)在该工艺中可循环使用的物质是______________;“加热驱氨” 环节,温度不能过低也不能过高的原因为___。
(4)请根据如下图示,将“由碳酸锰经一系列操作获得MnSO4·H2O晶体,并测定纯度”的实验方案补充完整。
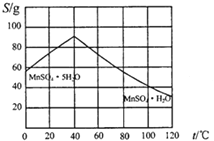
①将碳酸锰固体溶于稀硫酸获得硫酸锰溶液;
②加热溶液并控制温度>40℃,_________得到粗产品;
③_______,低温干燥,可得到较纯晶体。
④欲测定该品体的纯度,取14.00g晶体加蒸馏水配成100mL溶液,量取25.00mL,加足量标准BaCl2溶液,得到沉淀4.66g,则此样品的纯度为___(保留四位有效数字)。某小组计算发现本组样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有__(任写一种)。
-
辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
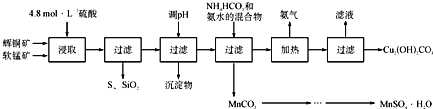
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe 3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
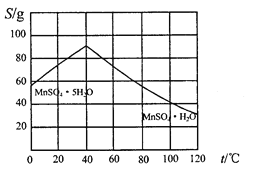
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
-
辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有________________________(任写一点)。
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程式________________________。
(3)调节浸出液pH的范围为________,其目的是________________。
(4)本工艺中可循环使用的物质是________________________(写化学式)。
(5)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成________的结果。
(6)用标准BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有________________(任写一种)。
-
辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
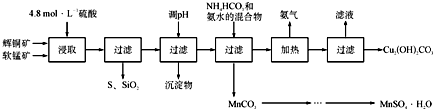
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| 开始沉淀的pH | 沉淀完全的pH |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
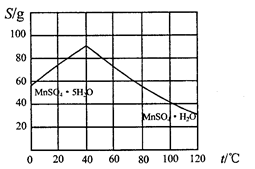
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
-
辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :
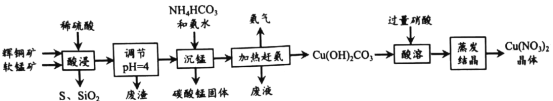
已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
| 开始沉淀的 pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ mol•L-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
-
辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:
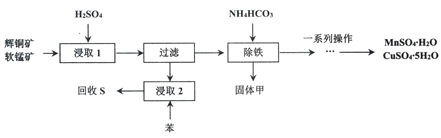
(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
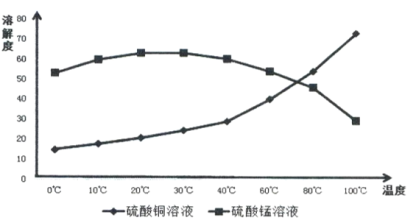
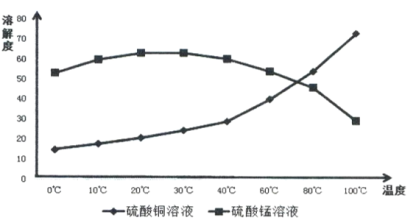
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体
-
辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:

(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体