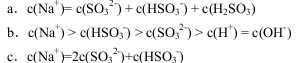-
硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH+Ca2++2OH-+SO ===CaSO3↓+2NH3·H2O。
===CaSO3↓+2NH3·H2O。
(1)已知:25 ℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=__________(用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.2CO(g)+SO2(g)  S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
ⅱ.2H2(g)+SO2(g)  S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
(2)写出CO(g)与H2O(g)反应生成CO2(g) 、H2(g)的热化学方程式为_______________。
若该反应在绝热、恒容体系中进行,达到平衡的标志___________。
A.氢氧键的断裂速率等于氢氢键的断裂速率
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D. H2O(g) 与H2(g)的体积比保持不变
(3)反应ⅱ的正反应的活化能E________(填“>”“<”或“=”)ΔH2。
(4)在一定压强下,发生反应ⅱ。平衡时,α(SO2) (二氧化硫的转化率)与原料气投料比[ ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。
①α(H2):M________(填“>”“<”或“=”)N。
②逆反应速率:M________(填“>”“<”或“=”)Q。
(5)T ℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol SO2(g)和2 mol H2(g),发生反应ⅰ和反应ⅱ。5 min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应ⅱ的平衡常数K=________。
②其他条件不变,6 min时缩小容器容积。α(SO2)__________(填“增大”“减小”或“不变”),原因为_____________________________________________________________。
-
含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答:
I .碱液吸收法
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应2NH4++Ca2++2OH-+SO32-=CaSO3↓+2NH3·H2O
(1)步骤1中反应的离子方程式为_______________________。
(2)已知:25°C时,Ksp(CaSO3)=b,步骤2中反应的平衡常数K=a。该温度下,Kb( NH3·H2O)=__________________(用含a、b的代数式表示)。
II.水煤气还原法
己知:①2CO(g)+SO2(g) S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
②2H2(g)+ SO2(g) S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
③CO的燃烧热△H3=-283 kJ·mol-1
(3)1 molS(l)在O2(g)中完全燃烧生成SO2(g)的热化学方程式为____________。
⑷反应②的正反应的活化能为E1 kJ·mol-1,其逆反应的活化能E2=_____ kJ·mol-1。
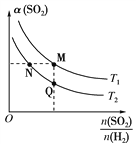
(5)在一定压强下,发生反应②。平衡时,α(SO2)与原枓气投料比[ ]和温度(T) 的关系如图所示。
]和温度(T) 的关系如图所示。
①α(H2):N_____M (填“>”、“<”或 “ = ”)。
②逆反应速率:M_____Q(填“>”、“<”或 “ = ”)。
(6)t℃时,向10L恒容密闭容器中充入2 molCO(g)、2 mol SO2(g)和2 mol H2(g)。发生反应①和反应②。5mim达到平衡时,SO2(g)和CO2(g) 的物质的量分别为0.4mol、1.6mol。该温度下,反应②的平衡常数K=__________。
-
煤燃烧排放的烟气含有SO2和NOx(主要成分为NO、NO2的混合物),对烟气进行脱硫、脱硝有多种方法。
(1)碱液吸收法:采用石灰乳脱除SO2.脱除后的主要产物是_____。
(2)液相氧化法:采用 NaClO溶液进行脱除。
①NaClO水解的离子方程式是_____。
②NaClO溶液吸收NO的主要过程如下
i.NO(aq)+HClO(aq)⇌NO2(aq)+HCl(aq) △H1
ii.3NO2(aq)+H2O(1)⇌2HNO3(aq)+NO(aq) △H2
NO(aq)转化为HNO3(aq)的热化学方程式是_____。
③研究pH对NO脱除率的影响。调节 NaClO溶液的初始pH,NO的脱除率如表:
| 初始pH | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
| NO脱除率 | 91% | 88% | 83% | 65% | 51% |
pH影响NO脱除率的原因是_____。
(3)研究发现,在液相氧化法中,一定量的SO2能提高NOx的脱除率。当pH=5.5时,SO2对有效氯含量、NOx脱除率的影响如图所示。
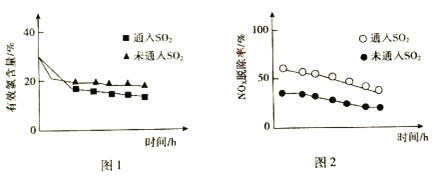
①据图1,通入SO2后有效氯含量降低。SO2和HClO反应的离子方程式是_____。
②针对图2中NOx脱除率提高的原因,研究者提出了几种可能发生的反应:
A.SO2+2NO+H2O═N2O+H2SO4
B.2SO2+2NO+2H2O═N2+2H2SO4
C.4SO2+2NO2+4H2O═N2+4H2SO4
用同位素示踪法确认发生的反应:把15NO2和NO按一定比例混合,通入SO2的水溶液中,检测气体产物。
a.气体产物中主要含有15NO2、N2O,则发生的主要反应是_____(填序号)。
b.同时检测到气体产物中还有15N N,产生15N N的化学方程式是_____。
-
烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
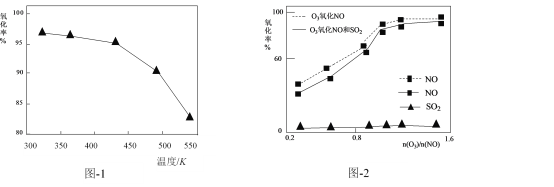
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。
-
煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随 变化关系如下表:
变化关系如下表:

①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
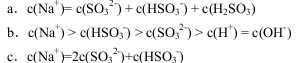
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+ CO (g) CaO(s)+ SO2 (g)+ CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+ SO2 (g)+ CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
CaS(s)+ 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
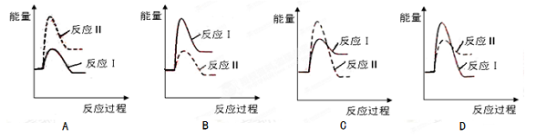
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数 的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
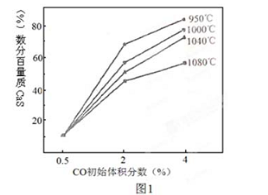
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
-
煤燃烧排放的烟气含有NOx,容易形成酸雨污染环境,可通过多种化学方法对烟气进行脱硝处理。回答下列问题:
(1)在无氧条件下,脱硝反应为:6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g)△H=-1807.0kJ•mol-1,T℃时,在恒容的密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 |
| n(NO)/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
| n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
①下列说法正确的是______(填序号)。
A.3min后NO和NH3的浓度都不再变化,反应停止进行
B.前2min内的平均反应速率v(N2)=0.20mol•L-1•min-1
C.达到平衡时NO的转化率为50%
D.及时分离出N2,可使该反应的反应速率增大,平衡正向移动
②若反应开始的压强为p0,则该反应的化学平衡常数Kp=______(可用分数表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)在有氧条件下,NOx也能发生脱硝反应。
①已知:N2(g)+O2(g)=2NO(g)△H=180.6kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
H2O(g)=H2(g)+ O2(g)△H=241.8kJ•mol-1
O2(g)△H=241.8kJ•mol-1
则脱硝反应4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)△H=______kJ•mol-1
②臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)⇌N2O5(g)+O2(g)△H<0,反应在恒容密闭容器中进行,NO2的百分含量随压强(p)、x的变化如图所示:
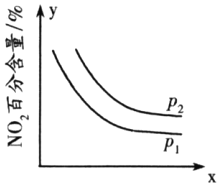
则p1______p2(填“>”“<”或“=”),x表示的物理量除时间外,还可能是______。
(3)利用惰性电极电解也能对烟气进行脱硝处理。电解原理如图所示:
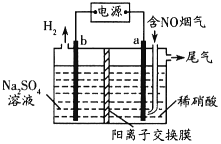
电极a的电极反应式为______,当电解44.8L(标准状况)含5%NO的烟气,理论上电路中通过电子的物质的量为______mol。
-
煤燃烧排放的烟气含有NOx,容易形成酸雨污染环境,可通过多种化学方法对烟气进行脱硝处理。回答下列问题:
(1)在无氧条件下,脱硝反应为:6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g)△H=-1807.0kJ•mol-1,T℃时,在恒容的密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 |
| n(NO)/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
| n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
①下列说法正确的是______(填序号)。
A.3min后NO和NH3的浓度都不再变化,反应停止进行
B.前2min内的平均反应速率v(N2)=0.20mol•L-1•min-1
C.达到平衡时NO的转化率为50%
D.及时分离出N2,可使该反应的反应速率增大,平衡正向移动
②若反应开始的压强为p0,则该反应的化学平衡常数Kp=______(可用分数表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)在有氧条件下,NOx也能发生脱硝反应。
①已知:N2(g)+O2(g)=2NO(g)△H=180.6kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
H2O(g)=H2(g)+ O2(g)△H=241.8kJ•mol-1
O2(g)△H=241.8kJ•mol-1
则脱硝反应4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)△H=______kJ•mol-1
②臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)⇌N2O5(g)+O2(g)△H<0,反应在恒容密闭容器中进行,NO2的百分含量随压强(p)、x的变化如图所示:
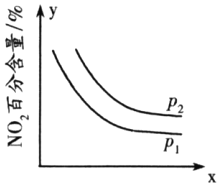
则p1______p2(填“>”“<”或“=”),x表示的物理量除时间外,还可能是______。
(3)利用惰性电极电解也能对烟气进行脱硝处理。电解原理如图所示:
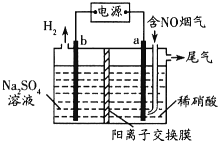
电极a的电极反应式为______,当电解44.8L(标准状况)含5%NO的烟气,理论上电路中通过电子的物质的量为______mol。
-
二氧化硫是形成酸雨的罪魁祸首之一,含硫煤燃烧的尾气处理一直是化学研究的重要课题。某工厂设计了新的治污方法,该工艺流程如图所示,下列叙述不正确的是( )
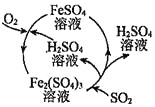
A.该过程中可得到化工产品
B.该工艺流程中 可以循环利用
可以循环利用
C.若处理含 的尾气,理论上需要通入相同条件下的空气约
的尾气,理论上需要通入相同条件下的空气约
D.可用澄清石灰水检验最终排出的气体是否含有二氧化硫
-
二氧化硫是形成酸雨的罪魁祸首之一,含硫煤燃烧的尾气处理一直是化学研究的重要课题。某工厂设计了新的治污方法,该工艺流程如图所示,下列叙述不正确的是( )
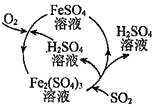
A.该过程中可得到化工产品
B.该工艺流程中 可以循环利用
可以循环利用
C.若处理含 的尾气,理论上需要通入相同条件下的空气约
的尾气,理论上需要通入相同条件下的空气约
D.可用澄清石灰水检验最终排出的气体是否含有二氧化硫
-
烟气脱硫能有效减少二氧化硫的排放。其研究性学习小组在实验室利用下列装置制备模拟烟气(主要成分SO2、CO2、N2、O2),并测定烟气中SO2的体积分数以及研究通过转化器的脱硫效率:
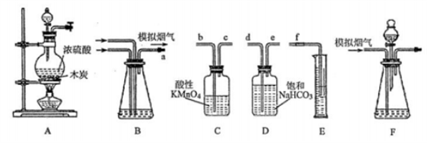
回答下列问题:
1-模拟烟气的制备
(1)写出装置A中发生化学反应的化学方程式___________;检查装置A气密性的方法是_______。
2-测定烟气中SO2的体积分数
(2)欲测定烟气中SO2的体积分数,则装置按气流方向的接口顺序为a____________。
(3)①甲同学认为应该在装置_____(填字母)之间增加一个盛有品红溶液的洗气瓶,理由是_______。
②在准确读取量筒读数之前______、并上下移动量筒使得量筒液面与广口瓶液面相平。
(4)乙同学根据模拟烟气的流速,(amL/min)和t min后量筒内液体的体积(V mL)测得二氧化硫的体积分数,其结果总是偏大,原因可能是__________________。
3-模拟烟气通过转化器的脱硫效率研究
(5)将模拟烟气通过装置F,其中盛有FeCl2,FeCl3的混合溶液,它可以催化SO2与氧气的反应以达到脱硫的目的。
①写出催化剂参与反应过程中的离子方程式:____________________。
②丙同学在此实验过程中发现黄色溶液先变成红棕色,查阅资料得Fe3++ 6SO2=[Fe(SO2)6]3+(红棕色),请用化学平衡移动原理解释实验中溶液颜色变化的原因:_______________。
===CaSO3↓+2NH3·H2O。
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
]和温度(T)的关系如图所示。