-
(12分)常温下,如果取0.1mol·L-1HCl溶液与0.1mol·L-1MOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=5,请回答下列问题:
(1)混合后溶液的pH=5的原因(用离子方程式表示):
(2)混合溶液中由水电离出的H+浓度是0.1mol·L-1HCl溶液中由水电离出的H+浓度的 倍。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)= mol·L-1,c(H+)-c(MOH)= mol·L-1。
(4)已知CH3COOM溶液为中性,HF常温下电离常数为6.8×10-4,CH3COOH电离常为1.7×10-5。
则MF溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.MHCO3 B.CH3COOM C.MClO D.MCl
按pH由小到大的顺序排列: (填序号)。
高二化学填空题困难题查看答案及解析
-
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1HCl溶液与0.2 mol·L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A________B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH_____7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh=______mol/L
高二化学填空题困难题查看答案及解析
-
常温下,用0.02mol•L-1MOH溶液滴定100mL0.01mol•L-1HA溶液,右图为加入MOH溶液的体积与混合溶液的pH变化情况(溶液体积变化勿略不计)。
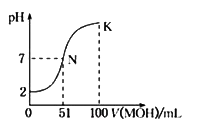
回答下列问题:
(1)由图中信息可知HA为_____酸(填“强”或“弱”),滴定所用的最适宜指示剂为______,滴定时眼睛注视__________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_____7(填“大于”、“小于”或“等于”)此时,溶液中水电离出的c(OH-)=__________。
(3)请写出K点所对应的溶液中离子浓度的由大到小的关系:_______________。
(4)K点所对应的溶液中,c(M+)+c(MOH)______2c(A-)。(填“大于”“小于”“等于”)
(5)室温下MOH溶液加水稀释过程中,下列数值变小的是_______________(填序号)
①C(H+) ② C(H+)/ C(OH-) ③ C(OH-) ④ C(OH-)/ C(M+)
高二化学简答题困难题查看答案及解析
-
常温下,向 100 mL
0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽
略不计)。回答下列问题:
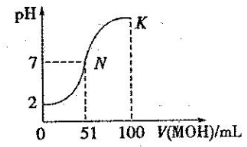
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH = a,则a_________7(填“ > ”、“< ”或“=”),用离子方程式表示其原因:_____________________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:____________________。
(4)K点对应的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =_____________mol· L-1。
高二化学填空题困难题查看答案及解析
-
(12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
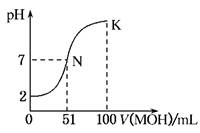
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分)
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。(4分)
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________ (2分)
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分)
高二化学填空题简单题查看答案及解析
-
(10分)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
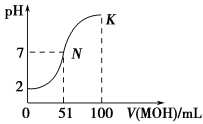
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是_________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因: 。
(3)若此时溶液的pH=10,则c(MOH)+c(OH-)=________mol·L-1。
高二化学填空题中等难度题查看答案及解析
-
(12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
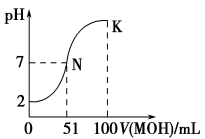
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
高二化学填空题中等难度题查看答案及解析
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为 酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH = a,则a______________7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: _____________________,此时,溶液中由水电离出的c(OH-)=_________
(3)请写出K点所对应的溶液中离子浓度的大小关系______________________。
(4)K点对应的溶液中,溶液的 pH = 10,则 c(MOH) +c(OH-) =_________________mol· L-1。
高二化学填空题困难题查看答案及解析
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
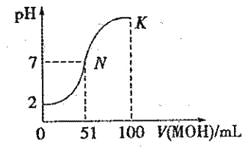
(1)由图中信息可知HA为__________酸(填“强”或“弱”),理由是______________。
(2)常温下一定浓度的MA稀溶液的pH = a,则a___7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)=______________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH)_____2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =________mol· L-1。
高二化学填空题简单题查看答案及解析
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
高二化学填空题简单题查看答案及解析