-
某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图:
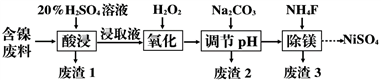
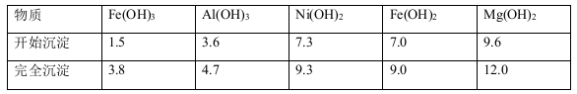
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图。
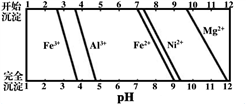
②25℃时,NH3·H2O的电离常数Kb=1.8×10-5。
HF的电离常数Ka=7.2×10-4,Ksp (MgF2)=7.4×10-11。
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是__________(填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理解释(用必要的文
字和离子方程式回答)_______________________________________。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=________ mol·L-1(列出计算式即可)。
NH4F溶液呈 _____(填“酸性”、“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=_______ mol·L-1。
(5)在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),化学方程式为________________________________;NiO(OH)与贮氢的镧镍合金可组成镍氢碱性电池(KOH溶液),工作原理为:LaNi5H6+6NiO(OH)  LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。
LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。
-
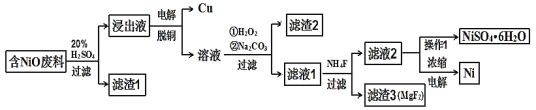
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如图:
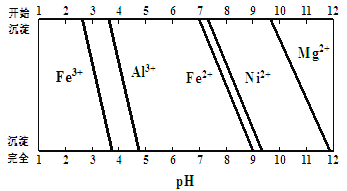
(1)滤渣1的主要成分为____。
(2)①用离子方程式解释加入H2O2的作用____。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为____。
(3)从滤液2中获得NiSO4·6H2O的实验操作是____、过滤、洗涤、干燥。
(4)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如图:
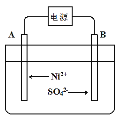
①B极附近pH会____(填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因:____。
②一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni____g。
-
(15分)某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
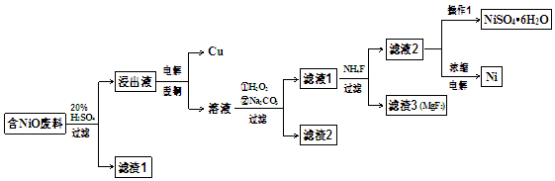
已知:有关金属离子生成氢氧化物沉淀所需的pH如下图:

(1)滤渣1的主要成分为 。
(2)电解脱铜:金属铜在 极析出。
(3)①用离子方程式解释加入H2O2的作用 。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为 。
(4)从滤液2中获得NiSO4.6H2O的实验操作是 、过滤、洗涤、干燥。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下:

①A极的电极反应式为 和2H++2e-=H2↑。
②B极附近pH会 (填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因: 。
③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni g。
-
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
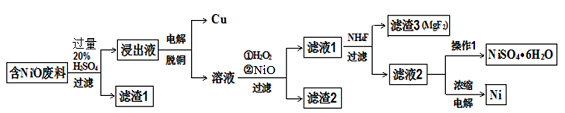
已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
(1)滤渣1的主要成分为 。
(2)从滤液2中获得NiSO4.6H2O的实验操作 、 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用 。
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:
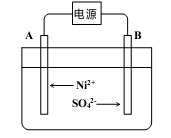
①A电极反应式为 和2H++2e- =H2↑。
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni g。
-
NiSO4是制备磁性材料和催化剂的重要中间体。用含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)制备NiSO4并回收金属资源的流程如图:
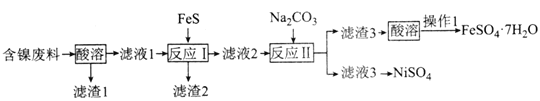
下列说法错误的是( )
A.“酸溶”时应选用硫酸
B.滤渣2的成分为CuS和FeS
C.“操作1”为蒸发结晶
D.合理处理废弃物有利于保护环境和资源再利用
-
某含镍 废料中有FeO、
废料中有FeO、 、MgO、
、MgO、 等杂质,用此废料提取
等杂质,用此废料提取 的工艺流程如图1:
的工艺流程如图1:
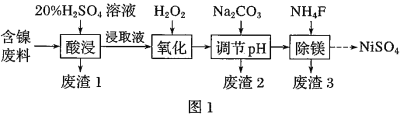
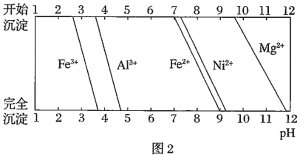
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
② 时,
时, 的电离常数
的电离常数 的电离常数
的电离常数 ,
,
 .
.
(1)加 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______ 填化学式
填化学式 .
.
(2) 能与饱和
能与饱和 溶液反应产生
溶液反应产生 ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答 ______.
______.
(3) 时,
时, 的NaF溶液中
的NaF溶液中 ______
______  列出计算式即可
列出计算式即可 溶液呈______
溶液呈______ 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性” .
.
(4)已知沉淀前溶液中 ,当除镁率达到
,当除镁率达到 时,溶液中
时,溶液中 ______
______  .
.
(5)在NaOH溶液中用NaClO与 反应可得
反应可得 ,化学方程式为____________;
,化学方程式为____________; 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池 溶液
溶液 ,工作原理为:
,工作原理为: ,负极的电极反应式:______.
,负极的电极反应式:______.
-
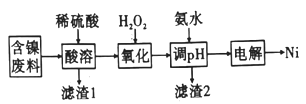
金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀。下图是一种以含镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:
已知:室温下难溶物的溶度积数据如下表:
| 化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)实验中需用0.8mol/L的稀硫酸800mL,若用98%的浓硫酸(ρ=1.84g·mL-l)来配制,量取浓硫酸
时,需使用的量筒的规格为_________(填序号)。
A.10mL B.20mL C.50mL D.l00tnL
(3)用离子方程式解释加入H2O2的作用:_________________。
(4)滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。
(5)电解制备镍的反应原理如图所示,则A电极的反应式为2H++2e-=H2↑和___________________。
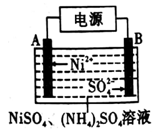
(6)若用a kg含镍废料(含NiO 80%)制备Ni,最终得到产品b kg,则产率为_____________。
-
从某矿渣(成分为NiFe2O4、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
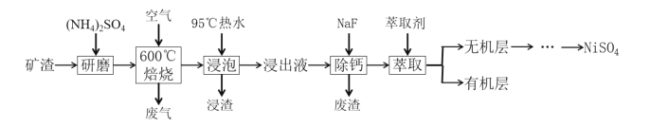
已知①600℃时发生反应:NiFe2O4+4H2SO4═NiSO4+Fe2(SO4)3+4H2O
②Ksp(CaF2)=4.0×10-11
回答下列问题:
(1)将NiFe2O4写成氧化物的形式为__;(NH4)2SO4的作用是__。
(2)“焙烧”时矿渣中部分FeO反应生成Fe2(SO4)3的化学方程式为__。
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有__(写化学式)。
(4)向“浸出液”中加入NaF以除去Ca2+,当溶液中c(F-)=2.0×10-3mol•L-1时,若除钙率为99%,则原“浸出液”中c(Ca2+)=__g•L-1。
(5)“萃取”后,分离得到无机层的操作为__,用到的主要玻璃仪器是__。
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4是倍受关注的一类新型、高效、无毒的多功能水处理剂。回答下列问题:
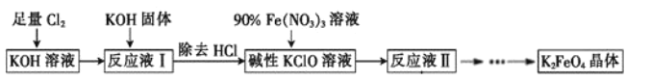
①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为__。
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是__。
-
工业上,以铁质镍矿(除NiO外,还含有Fe2O3、FeO、SiO2等杂质)和镁质镍矿(除NiO外,还含有MgO、CaO、SiO2等杂质)为原料炼镍的流程如下图:
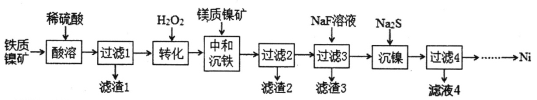
回答下列问题:
(1)滤渣1主要成分的化学式为___________,“转化”操作中加入H2O2的目的是_______。
(2)中和沉铁步骤中,不仅有Fe(OH)3沉淀,同时还产生Fe(OH)3胶体,导致c(Ni2+)明显降低,原因是_____________________;为减少镍的损失,可在中和的同时加入Na2SO4溶液,生成黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀,反应离子方程式为_____________________。
(3)已知Ksp(CaF2)=1.11×10-10、Ksp(MgF2)=7.40×10-11,在过滤2的滤液中加入过量NaF溶液,反应完全后,c(Ca2+)/c(Mg2+)=____。
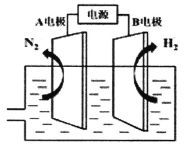
(4)我国研制出非贵金属镍钼基高效电催化剂,实现了低能耗电解富尿素废水制取H2(如图所示)。酸性条件下,总反应为CO(NH2)2+H2O 3H2↑+N2↑+CO2↑。B电极连接的电源的______极,A电极的电极反应为_______________________。
3H2↑+N2↑+CO2↑。B电极连接的电源的______极,A电极的电极反应为_______________________。
(5)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230℃时,K=2×10-5。己知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。则第一阶段在30℃和50℃两者之间选择的反应温度是__________;230℃时,第一阶段的转化率低于第二阶段的转化率,原因是_____________________。
Ni(CO)4(g)。230℃时,K=2×10-5。己知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。则第一阶段在30℃和50℃两者之间选择的反应温度是__________;230℃时,第一阶段的转化率低于第二阶段的转化率,原因是_____________________。
-
镍及其化合物用途广泛。某矿渣的土要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图1是从该矿渣中回收NiSO4的工艺路线:
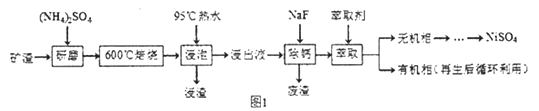
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中
生成NiSO4、Fe2(SO4)3。锡(Sn)位子第五周期第IVA族.
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________。
(2) "浸泡“过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有____________ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将 Fe3+还原为Fe2+ ,所需SnCl2的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+ ,还原产物为Cr3+,滴定时反应的离子方程式________________。
⑷“浸出液”中c(Ca2+) =1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=______mol·L-1。[己知Ksp(CaF2) > 4.0×10-11]
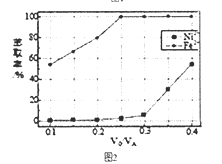
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,V0/VA的最佳取值是__________。
(6)己知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。己知电解总反应为:
2C6H13COONa + 2CH3OH C12H26 + 2CO2↑+H2↑+2CH3ONa
C12H26 + 2CO2↑+H2↑+2CH3ONa

下列说法正确的是(_____)
A.图中电源的A极为直流电源的负极
B.加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性
C.阳极电极反应为:2C6H13COO--2e- =C12H26+2CO2↑
D.反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备


LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。




















