-
工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)  N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①0~2 s 内用N2表示的化学反应速率为______该温度下,反应的平衡常数K1________。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___K2 (填“>”、“<”或“=”),原因是____________________。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)  2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。

下列说法正确的是_________(填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。
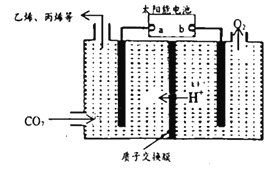
①该工艺中能量转化方式主要有___________________。
②电解时,生成乙烯的电极反应式是__________________________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
-
工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)  N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①0~2 s 内用N2表示的化学反应速率为______该温度下,反应的平衡常数K1________。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___K2 (填“>”、“<”或“=”),原因是____________________。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)  2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。

下列说法正确的是_________(填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有___________________。
②电解时,生成乙烯的电极反应式是__________________________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
-
工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)  N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①0~2 s 内用N2表示的化学反应速率为______该温度下,反应的平衡常数K1________。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___K2 (填“>”、“<”或“=”),原因是____________________。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)  2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。

下列说法正确的是_________(填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有___________________。
②电解时,生成乙烯的电极反应式是__________________________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
-
工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:
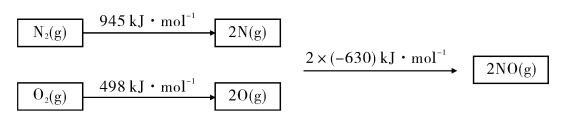
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g)  N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
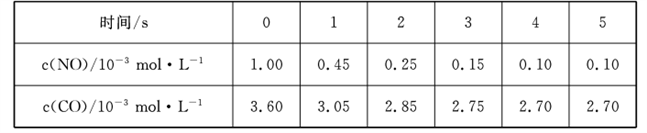
①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g)  2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
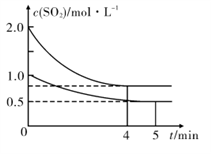
A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。

①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
-
工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) == CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
2H2(g)+O2(g) == 2H2O(l) ΔH=-b kJ·mol-1;
CH3OH(g) == CH3OH(l) ΔH=-c kJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
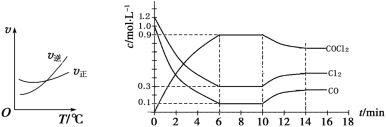
①0~6 min内,反应的平均速率v(Cl2)=__________;
②10min改变的条件是________,该反应平衡常数变化的趋势是_____(填“增大”、“减小”或“不变”)。
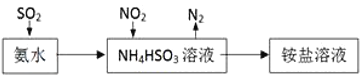
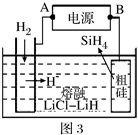
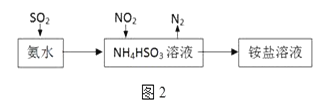
(3) 利用氨水可以将SO2和NO2吸收,原理如图所示:


NO2被吸收的离子方程式是____________________。
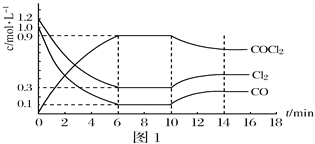
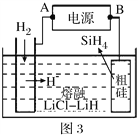
(4)用粗硅作原料,熔融盐电解法制取硅烷原理如右图,判断B为电源的______极,电解时阳极的电极反应式为___________________。
-
工业产生的废气COx、NOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)NOx是大气污染物,处理NOx的一种方法是利用甲烷催化还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+2NO2 (g)= N2(g)+CO2(g)+2H2O(g) △H2=-867kJ·mol-1
若用标准状况下2.24L CH4还原NO生成N2,则放出的热量为 kJ。
(2)工业上利用CO合成COCl2,反应为Cl2(g)+CO(g) COCl2(g) △H<0。下图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g) △H<0。下图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
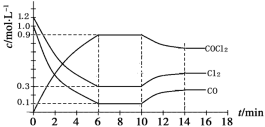
①0~6 min内,反应的平均速率v(Cl2)=__________;
②10min改变的条件是 ,该反应平衡常数变化的趋势是 (填“增大”、“减小”或“不变”)。
③下列措施中,能提高COCl2产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,反应得淡黄色固体和一种无色气体,则反应方程式为 。
(4)利用CO和H2制备二甲醚(CH3OCH3)。以KOH为电解质溶液,组成二甲醚——空气燃料电池,该电池工作时其负极反应式是 。
-
合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:_______________________。
(2)光气(COCl2)是重要化工原料,常用于聚酯类材料的生产,工业通过Cl2(g)+CO(g)⇌COCl2(g)△H < 0制备。图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
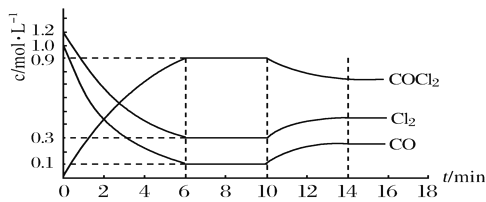
①0~6min内,反应的平均速率v(Cl2)=___________;
②该反应第一次达平衡时的平衡常数为___________,10min改变的条件是_____________。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:NO2被吸收的离子方程式是________________________________。
(4)对于2NO(g)+2CO(g) N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.2v(N2)正=v(NO)逆 D.容器中混合气体的平均摩尔质量不变
-
合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
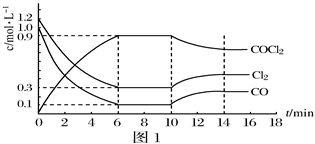
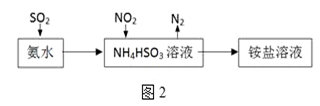
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
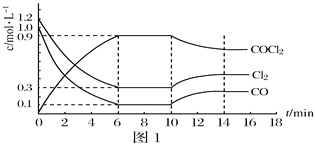
①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
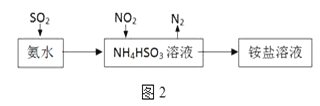
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。
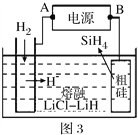
(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。
-
合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。
(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。
-
合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。
(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(moI/L)随时间t(min)的变化关系如图所示。


























