-
请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) ∆H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____ kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____ mol/L。
若加入少量NaOH固体,则溶液中 _____ (填"增大”、“减小”或“不变”)。
_____ (填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。
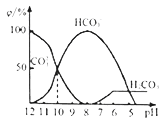
①在同一溶液中,H2CO3、HCO3-、CO32- ____ (填“能”或“不能”) 大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______。当pH=7时,溶液中含碳元素的微粒主要为_________。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=_____。
HCO3-+OH-的平衡常数Kh=_____。
-
(11分)请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1。则相同条件下破坏化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中 _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
-
请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=________mol·L-1;往溶液中加入少量NaOH固体,则溶液中 ___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为___________。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=___________。
HCO3-+OH-的平衡常数Kh=___________。
-
请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
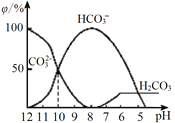
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
-
Ⅰ.(1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是___,NO分子中化学键的键能为___kJ·mol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2 Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为________________;充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __

-
已知H2、O2、Cl2、N2分子中共价键的键能依次为436 kJ·mol-1、497 kJ·mol-1、243 kJ·mol-1、946 kJ·mol-1,
(1)下列叙述正确的是 ( )。
A.N—N键键能为 ×946=315.3kJ·mol-1
×946=315.3kJ·mol-1
B.氮分子中共价键的键长比氢分子中共价键的键长短
C.氧分子中氧原子是以共价单键结合的
D.氮分子比氯分子稳定
(2)计算反应3Cl2+2NH3=N2+6HCl(EN-H=391 kJ·mol-1,EH-Cl=432 kJ·mol-1)的反应热。
-
已知H—H键的键能为436 kJ﹒mol-1,O=O键为497.3 kJ﹒mol-1,Cl—Cl键为242.7 kJ·mol-1,N≡N键为946 kJ·mol-1,则下列叙述中正确的是( )
A. N—N键的键能为 ×946 kJ·mol-1=315.3 kJ·mol-1
×946 kJ·mol-1=315.3 kJ·mol-1
B. 氮气分子中的共价键的键长比氢气分子中的短
C. 氧气分子中氧原子是以共价单键结合的
D. 氮气分子比氯气分子稳定
-
已知H—H键的键能为436 kJ﹒mol-1,O=O键为497.3 kJ﹒mol-1,Cl—Cl键为242.7 kJ·mol-1,N≡N键为946 kJ·mol-1,则下列叙述中正确的是
A. N—N键的键能为×946 kJ·mol-1=315.3 kJ·mol-1
B. 氮气分子中的共价键的键长比氢气分子中的短
C. 氧气分子中氧原子是以共价单键结合的
D. 氮气分子比氯气分子稳定
-
肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
| N≡N | O=O | N-N | N-H | O-H |
| 键能(KJ•mol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)⇌N2(g)+2H2O(l) ∆H=________KJ•mol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) ∆H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) ∆H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:

起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
| Fe | H2O(g) | Fe3O4 | H2 |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列说法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A. 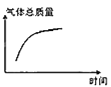 B.
B. 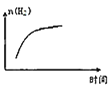 C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。
-
已知:N2+O2  2NO △H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
2NO △H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
A.812 kJ/mol B.632 kJ/mol C.1264 kJ/mol D.1624 kJ/mol
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。

HCO3-+OH-的平衡常数Kh=______________________。
 _____ (填"增大”、“减小”或“不变”)。
_____ (填"增大”、“减小”或“不变”)。



 B.
B.  C.
C. 