-
[2012·课标全国卷] (14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物为FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为__________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________
______________________________;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________________,该电池总反应的离子方程式为_____________________________________。
高三化学填空题中等难度题查看答案及解析
-
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。已知氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成
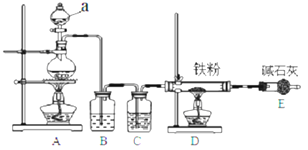
(1)某学习小组用如图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
①装置A 中仪器 a的名称是 ______ 。
②装置B的作用是 ______ ,C 中的试剂 ______ 。
③实验开始时先点燃 ______ 处酒精灯;装置 E的作用为 ______ 。
(2)工业上制备无水氯化铁的一种工艺流程如下:
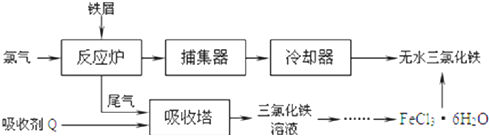
①吸收塔中发生反应的离子方程式为 ______
②简述由
晶体得到无水氯化铁的操作: ______
高三化学综合题中等难度题查看答案及解析
-
(9分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________;
高三化学计算题困难题查看答案及解析
-
(12分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式。可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预防处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量为________mol,并求出FeClx中X值为__________。
(2)现有一含有FeCl2和FeCl3的混合样品,采用上述方法测得n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为____________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和_______反应制备
(3)铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
①写出制取铁酸钠的化学方程式:________。
②铁酸钠之所以有净水作用,除杀菌外,另一个原因是________。
高三化学填空题简单题查看答案及解析
-
(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
高三化学简答题中等难度题查看答案及解析
-
Ⅰ.铁是应用最广泛的金属,铁的卤化物、氯化物以及高价铁的含氧酸盐均为重要化合物。已知氧化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
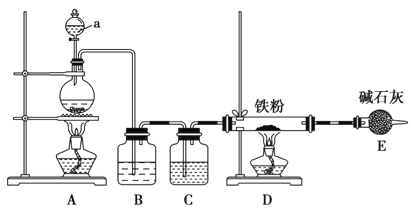
①装置A中发生的离子方程式_______________
②装置B的作用是________,C中的试剂______________。
③实验开始时先点燃___处酒精灯;装置E的作用为__________。
(2)工业上制备无水氯化铁的一种工艺流程如下:
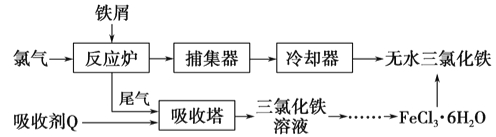
①吸收塔中发生反应的离子方程式为__________
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:____________
Ⅱ.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
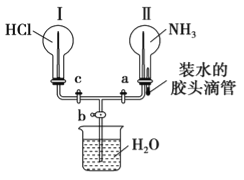
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______。
(2)若先打开a、c活塞,再挤压胶头滴管(假设NH3不能被完全吸收),在烧瓶Ⅱ中可观察到的现象是_____。
(3)通过挤压胶头滴管和控制活塞的开关,要在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________
高三化学实验题中等难度题查看答案及解析
-
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40mol•L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeClx中的x值:______(列出计算过程)
(2)现有一含有FeCl2和FeCl3的混合物的样品,采用上述方法测得n(Fe)﹕n(Cl)=1﹕2.1,则该样品中FeCl3的物质的量分数为______.在实验室中,FeCl2可用铁粉和______反应制备,FeCl3可用铁粉和______反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______.
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3 和KClO在强碱性条件下反应可生成K2FeO4,其反应的离子方程式为______.与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______.该电池总反应的离子方程式为______.高三化学解答题中等难度题查看答案及解析
-
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为________。
高三化学填空题中等难度题查看答案及解析
-
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40mol•L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeClx中的x值:______(列出计算过程)
(2)现有一含有FeCl2和FeCl3的混合物的样品,采用上述方法测得n(Fe)﹕n(Cl)=1﹕2.1,则该样品中FeCl3的物质的量分数为______.在实验室中,FeCl2可用铁粉和______反应制备,FeCl3可用铁粉和______反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______.
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3 和KClO在强碱性条件下反应可生成K2FeO4,其反应的离子方程式为______.与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______.该电池总反应的离子方程式为______.高三化学解答题中等难度题查看答案及解析
-
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:
__________________________________________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_____________________,该电池总反应的离于方程式为__________________________。
高三化学填空题困难题查看答案及解析