-
(16分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mo
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
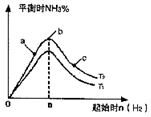
①图像中T2和T1的关系是:T2________T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________(填字母)。
③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
2N2O3 4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为________.
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
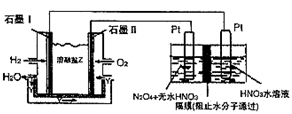
写出石墨I电极上发生反应的电极反应式________。
在电解池中生成N2O3的电极反应式为________。
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续地生产。请回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则NH3催化氧化生成NO和H2O(g)的热化学反应方程式可表示为: 。
(2)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
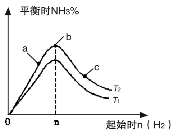
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是 。
②在起始时体系中加入N2的物质的量为1mol。若容器容积
为2L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
③图像中T1和T2的关系是:T1 T2。(填“>”“<”“=”“无法确定”)
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):
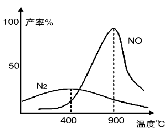
4NH3+5O2 4NO+6H2O ;
4NO+6H2O ;
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率可表示为____________________。
②下列情况能说明该反应已达平衡状态的是 。
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 .
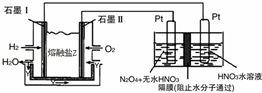
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.
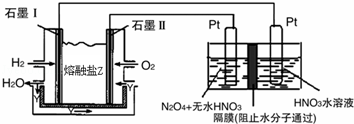
写出石墨I电极上发生反应的电极反应式 .
在电解池中生成N2O5的电极反应式为 .
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L.
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______;
(2)某科研小组研究在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)⇌2NH3(g)反应的影响,实验结果如图2所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1______T2(填“>”、“<”、“=”或“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______(填字母标号),
③在起始体系中加入N2的物质的量为______mol时,反应后氨的百分含量最大.若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=______;
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3⇌4NO2(g)+O2△H>0下表为反应在某温度下的部分实验数据则50s内NO2的平均生成速率为______
| V/s | | 50 | 100 |
| c(N2O3)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图1所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式______
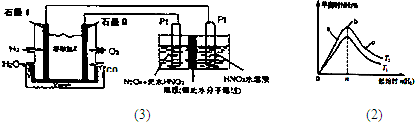
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______;
(2)某科研小组研究在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)⇌2NH3(g)反应的影响,实验结果如图2所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1______T2(填“>”、“<”、“=”或“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______(填字母标号),
③在起始体系中加入N2的物质的量为______mol时,反应后氨的百分含量最大.若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=______;
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3⇌4NO2(g)+O2△H>0下表为反应在某温度下的部分实验数据则50s内NO2的平均生成速率为______
| V/s | | 50 | 100 |
| c(N2O3)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图1所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式______
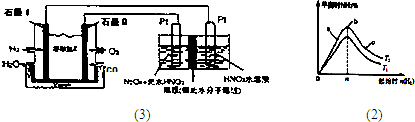
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 .
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式 .
在电解池中生成N2O5的电极反应式为 .
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)⇌2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L﹣1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1 K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是 (填序号);
A.2v(H2)(正)=3v(NH3)(逆)
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式 ;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是 (填序号).
A.c(Cl﹣)>c(N2H62+)>c(OH﹣)>c(H+)
B.c(Cl﹣)>c([N2H5•H2O+])>c(H+)>c(OH﹣)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)=c(Cl﹣)+c(OH﹣)
D.c(N2H62+)>c(Cl﹣)>c(H+)>c(OH﹣)
-
用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol,N2(g)+3H2(g)  2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
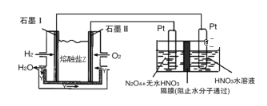
写出石墨I电极上发生反应的电极反应式_______________________________,在电解池中生成N2O5的电极反应式为__________________________________。
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为________L。
(4)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g) 
 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1106 | K1 | K2 | … |
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1_______ K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是_________(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式__________________________________;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是__________(填序号)。
A.c(Cl-)>c(N2H62+)> c(OH-)> c(H+)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
-
工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ.mol-1
2NH3(g) △H=-92.4kJ.mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | ...... |
| K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1___________K2(填“>”、“=”或“<”);
②在同温同压下判断该反应达到化学平衡状态的依据是___________(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。
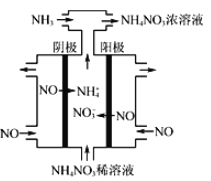
①其阴极的电极反应式为___________。
②常温下,1LpH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=___________mol·L-1。
(4)工业上生产尿素的化学方程式为:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
在T℃,体积为4L的密闭容器中,通入6molNH3和3 mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,e(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的V正___________V逆(填“>”“<”或“=”)。再次平衡后,平衡常数为___________。
(5)已知Ksp(AgCl)=1.8×10-10,若向50mL0.09mo1·L-1的AgNO3溶液中加入50mL0.10mol·L-1的盐酸,混合后溶液中的Ag+的浓度为___________mol·L-1。
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
 N2(g)+3H2(g)
N2(g)+3H2(g)  2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H= -483.6kJ/mol
氨气经催化氧化生成一氧化氮气体和水蒸气反应的热化学方程式为。
(2)在容积固定的密闭容器中发生上述氨气的催化氧化反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.54 | 0.9 | 0.56 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是________。
②反应在第2min到第4min时O2的平均反应速率为________;
③反应在第2min改变了反应条件,改变的条件可能是________或
________
④若反应在第6min后仅改变一种反应条件。所改变的条件和判断的理由是________
________ 。
-
(15分)工业上用N2和H2 合成NH3 “N2(g) + 3H2(g) 2NH3(g) ∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) =2NO(g) ∆H1= +a kJ·mol-1
N2(g) + 3H2(g) 2NH3(g) ∆H2=-b kJ·mol-1
2NH3(g) ∆H2=-b kJ·mol-1
2H2(g) + O2(g) =2H2O(g) ∆H3=-c kJ·mol-1
若有34 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(2)合成NH3达到平衡后,某时刻改变下列条件 ,在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
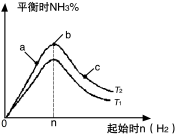
①图像中T2和T1的关系是:T2 T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最大的是 (填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度
为 mol·L-1。
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
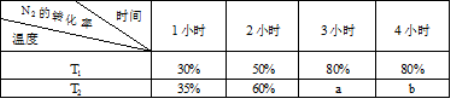
上表中a、b、80%三者的大小关系为 (填“>”、“=”、“<”、“无法比较”)。
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在下图中画出平衡常数K随时间的变化曲线。

N2(g)+3H2(g)
2NH3(g);△H= -92.4kJ/mol











