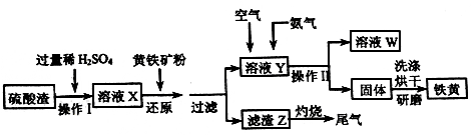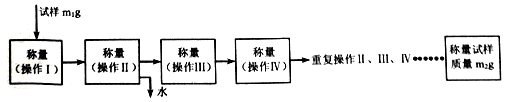-
(13分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
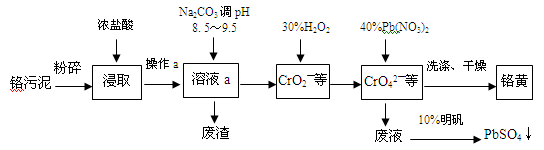
(1)操作a的名称为 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72
 -发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因 。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为 mol。
-
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、A12O3、 SiO2等)制备铬黄的工艺流程如下:
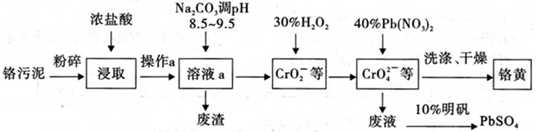
(1)将铬污泥粉碎的目的是________,操作a的名称为________;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为________(保留两位有效数字);
Al(OH)3+3H+的平衡常数为________(保留两位有效数字);
(3)写出加入30%H2O2过程中发生的离子反应方程式:________;
(4)实验室洗涤铬黄沉淀的方法:;
(5)写出浓盐酸与A12O3反应的离子方程式:________。
-
(12分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
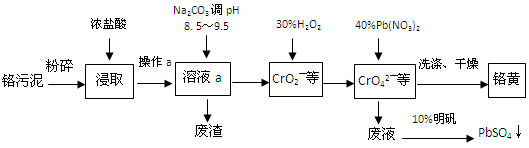
(1)将铬污泥粉碎的目的是________。操作a的名称为________。
(2)废渣的主要成分是Al(OH)3和Fe(OH)3。已知25℃时,Al(OH)3的Ksp=1.3×10—33,则该温度下反应Al3+ + 3H2O  Al(OH)3 +3H+的平衡常数为________。
Al(OH)3 +3H+的平衡常数为________。
(3)写出加入30%H2O2过程中发生的离子反应方程式:________。
(4)加入Pb(NO3)2沉淀CrO42—时,检验沉淀是否完全的方法是________。
(5)在废液中加入10%明矾溶液发生反应的化学方程式为________。
-
铬酸铅俗称铬黄,不溶于水.广泛用于涂料、油墨、漆布、塑料和文教用品等工业.实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
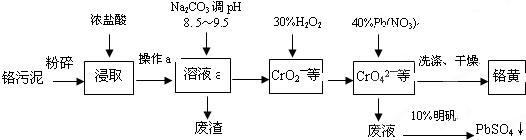
(1)将铬污泥粉碎的目的是______.操作a的名称为______.
(2)废渣的主要成分是Al(OH)3和Fe(OH)3.已知25℃时,Al(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为______.
Al(OH)3+3H+的平衡常数为______.
(3)写出加入30%H2O2过程中发生的离子反应方程式:______.
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是______.
(5)在废液中加入10%明矾溶液发生反应的化学方程式为______.
-
铬酸铅(PbCrO4)俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
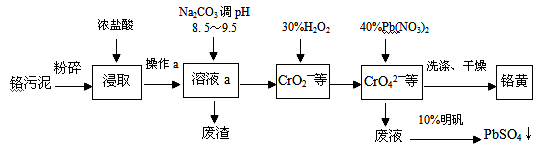
(1)铬黄中,铬的化合价为 价
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 ,操作a的名称为
(3)写出加入30%H2O2过程中发生的离子反应方程式
(4)在废液中加入10%明矾溶液发生反应的离子方程式为
(5)对含铬废水进行处理的方法是:将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①写出Fe2+和Cr2O72-发生反应的离子方程式
请分析电解过程中溶液pH不断上升的原因
-
铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下:
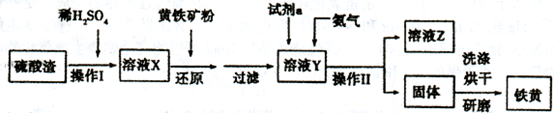
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_________、________
(2)试剂a最好选用_________(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_________。
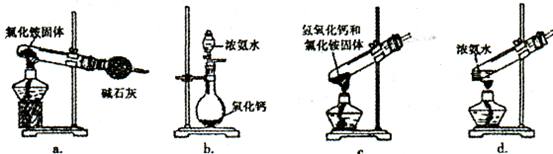
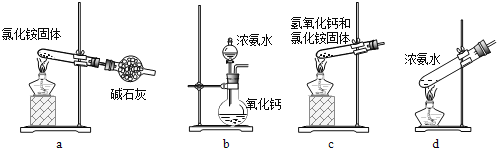
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是__________(填序号)。
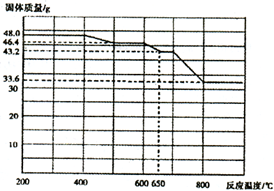
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4 、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。
| 加入试剂 | 现象 | 结论 |
| | 则还原产物为________ |
-
铁黄是一种重要的颜料,化学式为Fe2O3•xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等) 和黄铁矿粉(主要成分为FeS2) 制备铁黄的流程如下。
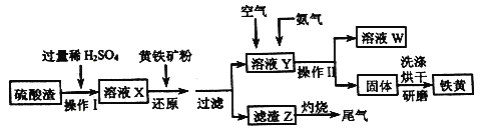
回答下列问题:
(1)操作I中为了提高硫酸渣的溶解速率,可采取的措施有_________(答两条即可)。
(2)溶液X中含有的金属离子有Fe3+和_____;溶液X中加入黄铁矿粉后,先发生反应FeS2+H2SO4( 稀)=FeSO4+ H2S↑+S↓,H2S 再将Fe3+还原,其离子方程式为_________。
(3)在溶液Y 中通入空气的目的是______________,再通入NH3后可观察到的现象是__________,若通入NH3后溶液的pH 过高,会影响产品纯度,原因是_________。
(4)操作II中除用到玻璃棒外,还需要的玻璃仪器是________。
(5)若将滤渣Z灼烧产生的尾气通入溶液X 中,充分反应后溶液的pH____(填“增大”、“减小”或“不变”)。
(6)为了测定所制备铁黄Fe2O3•xH2O中x的值,用分析天平准确称量m1g样品置于坩埚中加热、冷却后称量;经过重复操作,当达到恒重时,残留固体质量为m2g,则x =______。
-
铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:

(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是___、___。
(2)试剂a最好选用___(供选择使用的有:铝粉、空气、浓HNO3);其作用是___。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是___(填序号)。
(4)检验溶液Z中含有NH4+的方法是___。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如图所示。
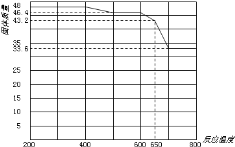
根据图象推断650℃时Fe2O3还原产物的化学式为___,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。___。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
-
铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:
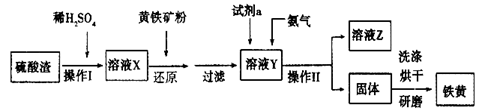
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是________、 ________。
(2)试剂a最好选用________(供选择使用的有:铝粉、空气、浓HNO3);其作用是________。
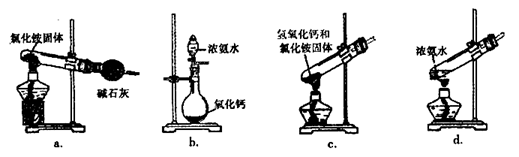
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是________(填序号)。
(4)检验溶液Z中含有 的方法是。
的方法是。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
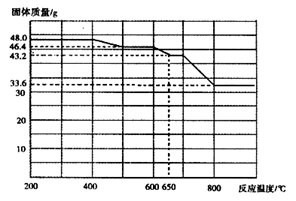
根据图象推断670℃时Fe2O3还原产物的化学式为________,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。________。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
-
铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:(已知:FeS2+H2SO4(稀)=FeSO4+H2S↑+S↓)
(1)操作I中为了提高硫酸渣的溶解速度,可采取的措施有____________,_________(任写两种)。
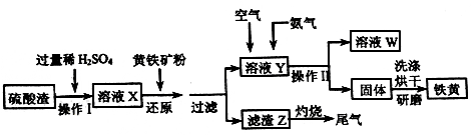
(2)滤液X中加入黄铁矿粉后,发生的还原反应离子方程式为_______________________;
(3)操作II中除用到玻璃棒外,还需要的玻璃仪器是____________;
(4)在溶液Y中通入空气的目的是____________;通入NH3发生的离子反应为___________。
(5)验证滤渣Z灼烧的尾气中含有SO2的方法____________________;
(6)为了测定制备铁黄中结晶水的含量,进行下列实验。
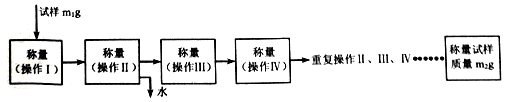
用分析天平准确称量m1g样品置于坩埚中加热、冷却;经过重复操作,当样品质量恒重时,测得质量为m2g,用算式表示出铁黄中结晶水的个数x=_________。
(7)拟用酸性高锰酸钾标准溶液滴定某亚铁盐溶液中Fe2+离子的浓度,请写出该反应的离子方程式_______,并叙述滴定终点的判断方法。

-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。