-
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是;
⑤写出该反应的化学方程式为________。
-
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是;
⑤写出该反应的化学方程式为________。
-
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是;
⑤写出该反应的化学方程式为________。
-
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是;
⑤写出该反应的化学方程式为________。
-
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的最佳物质的量之比为________ ;为了吸收该反应中产生的尾气,可选择的最佳装置是________(填序号)。
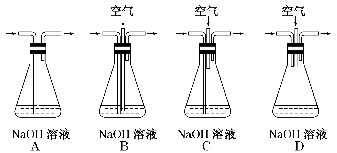
(2)为符合绿色化学的要求,某研究性学习小组进行如下 设计。
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再使氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与烯硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部转化为Fe(OH)3沉淀(一般当铁离子的浓度下降到10-5mol·L-1时,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:常温下,Ksp[Cu(OH)2]=10-22,Ksp[Fe(OH)3]=10-38)
请回答下列问题:
①方案1中仪器N的名称是________。
②方案2中为了使铁元素全部沉淀,应调节pH至少为________。
③方案2中甲物质可选用________(填序号)。
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
④方案2反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因:___________________________________________。
-
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为______;为了吸收该反应中产生的尾气,请选择下列中合适的装置______.
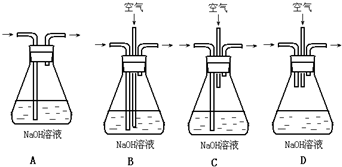
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀,然后过滤、浓缩、结晶.
已知:Ksp[Cu((OH)2]≈10-22,Ksp[Fe((OH)2]≈10-16,Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是______.
②为了使铁元素全部沉淀,应调节pH至少为______.
③方案2中甲物质可选用的是______.
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因______.
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL 1.5mol•L-1的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是______,
⑥本实验CuSO4•5H2O的产率为______.
-
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:________;为了吸收该反应中产生的尾气,请选择下列中合适的装置________。
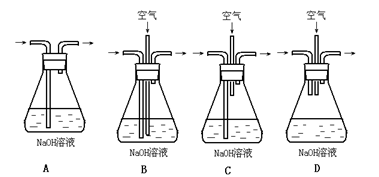
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。
①方案1中的B仪器名称是________。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是________。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因________。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是________,
⑥本实验CuSO4·5H2O的产率为________。
-
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为______;为了吸收该反应中产生的尾气,请选择下列中合适的装置______.
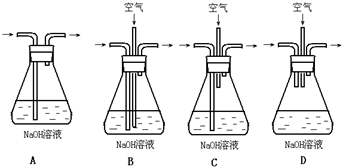
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀,然后过滤、浓缩、结晶.
已知:Ksp[Cu((OH)2]≈10-22,Ksp[Fe((OH)2]≈10-16,Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是______.
②为了使铁元素全部沉淀,应调节pH至少为______.
③方案2中甲物质可选用的是______.
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因______.
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL 1.5mol•L-1的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是______,
⑥本实验CuSO4•5H2O的产率为______.
-
(16分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ________ ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
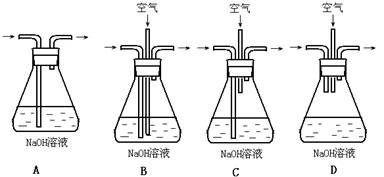
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器X中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
请回答下列问题:
①方案1中的仪器X名称是 。
②方案2为了使铁离子全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④方案2中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 ________
________ 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是
⑥本实验CuSO4·5H2O的产率为 。
-
(15分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:________:________;
为了吸收该反应中产生的尾气,请选择下列中合适的装置________。
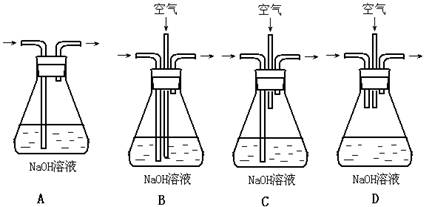
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是________。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是________。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因________。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是________,
⑥本实验CuSO4·5H2O的产率为________。





