-
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
| 温度/℃ | 250 | 600 | 1000 | 2000 |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g) CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
-
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。请回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g) Fe(s)+CO2(g) K1 ΔH1=a kJ·mol−1
Fe(s)+CO2(g) K1 ΔH1=a kJ·mol−1
3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) K2 ΔH2=b kJ·mol−1
2Fe3O4(s)+CO2(g) K2 ΔH2=b kJ·mol−1
Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) K3 ΔH3=c kJ·mol−1
3FeO(s)+CO2(g) K3 ΔH3=c kJ·mol−1
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=_____kJ·mol−1(用含a、b、c的代数式表示)。
2Fe(s)+3CO2(g) ΔH=_____kJ·mol−1(用含a、b、c的代数式表示)。
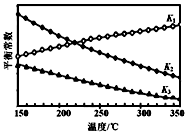
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图所示。则a_________b,(填“>”、“<”或“=”),理由是_________________。
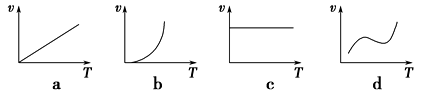
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。
(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g)
ΔH<0。在T℃,将l mol CO和3 mol H2加入2 L的密闭容器中。实验测得n(CO)随时间的变化如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
①下列能判断该反应达到平衡的标志是______(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20 min内v (H2)=______;在T℃时该反应的平衡常数K=_________。
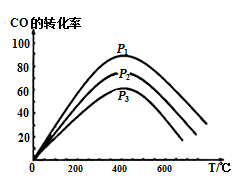
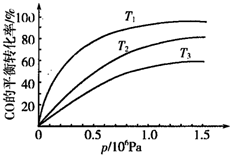
③下图表示该反应中CO的转化率与温度、压强的关系。图中压强P1、P2、P3由高到低的顺序是_________。
-
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+ CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+1/3 CO(g)═ 2/3 Fe3O4(s)+ 1/3 CO2(g)△H2
Fe3O4(s)+ CO(g)═3Fe(s)+CO2(g)△H3
Fe2O3(s)+ CO(g)═2Fe(s)+3CO2(g)△H4
则△H4 的表达式为_____(用含△H1、△H2、△H3 的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为_____,该温度下若测得固体混合物中 m(Fe):m(O)=35:2, 则 FeO 被 CO 还原为 Fe 的百分率为_________(设其它固体杂质中不含 Fe、O 元素)。
(3)铁等金属可用作 CO 与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g) = CH4(g) +H2O(g)△H<0.在 T℃,106Pa 时将 l mol CO 和 3mol H2 加入体积可变的密闭容器 中.实验测得 CO 的体积分数 x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断 CO(g)+3H2(g)⇌ CH4(g)+H2O(g)达到平衡的是_____(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v 正(CO)=3v 逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时 CO 的转化率为___________;在 T℃106Pa 时该反应的压强平衡常数 Kp(用平衡分 压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为_____。
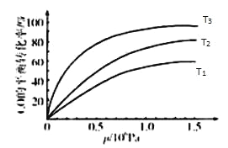
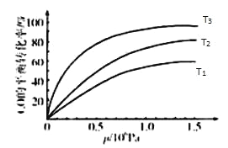
③图表示该反应 CO 的平衡转化率与温度、压强的关系.图中温度 T1、T2、T3 由高到低的顺序是_____,理由是_____________.
-
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+ CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+1/3CO(g)═ 2/3Fe3O4(s)+ 1/3 CO2(g)△H2
Fe3O4(s)+ CO(g)═3Fe(s)+CO2(g)△H3
Fe2O3(s)+ CO(g)═2Fe(s)+3CO2(g)△H4
则△H4 的表达式为_____(用含△H1、△H2、△H3 的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为_____,该温度下若测得固体混合物中 m(Fe):m(O)=35:2, 则 FeO 被 CO 还原为 Fe 的百分率为_________(设其它固体杂质中不含 Fe、O 元素)。
(3)铁等金属可用作 CO 与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g) = CH4(g) +H2O(g)△H<0.在 T℃,106Pa 时将 l mol CO 和 3mol H2 加入体积可变的密闭容器 中.实验测得 CO 的体积分数 x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断 CO(g)+3H2(g)⇌ CH4(g)+H2O(g)达到平衡的是_____(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v 正(CO)=3v 逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时 CO 的转化率为___________;在 T℃106Pa 时该反应的压强平衡常数 Kp(用平衡分 压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为_____。
③图表示该反应 CO 的平衡转化率与温度、压强的关系.图中温度 T1、T2、T3 由高到低的顺序是_____,理由是_____________.
-
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+ CO(g)═
CO(g)═ Fe3O4(s)+
Fe3O4(s)+ CO2(g)△H2
CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为__________(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为__________,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为__________(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g)△H<0.在T℃,106Pa时将lmolCO和3molH2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断CO(g)+3H2(g) CH4(g)+H2O(g)达到平衡的是__________(填序号).
CH4(g)+H2O(g)达到平衡的是__________(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为__________;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为__________;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是__________,理由是__________。
-
铁及其化合物在生产、生活中有广泛应用,请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K= ;△H 0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是 .
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正 υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)= .
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是 ;生成0.5mol K2FeO4转移电子的物质的量是 mol.
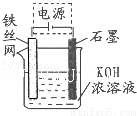
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为 .
-
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=___;△H___0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是_____.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=_____.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是_____;生成1mol K2FeO4转移电子的物质的量是_____mol.
-
(15分)铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理___________。
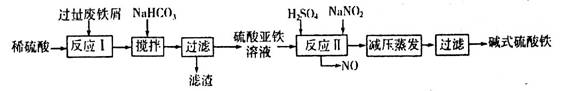
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
-
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理______.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
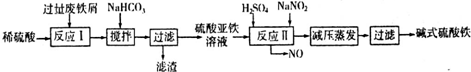
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式______.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为______.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为______g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为______.
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式______.
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式______.
-
铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_______________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
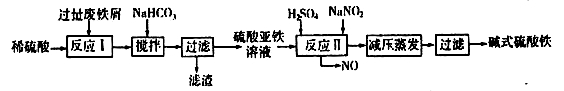
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
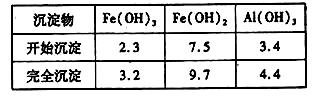
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。












