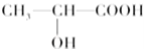-
下列说法正确的是( )
A.因为p轨道是“8”字形的,所以p电子走“8”字形
B.第三电子层,有3s、3p、3d三个轨道
C.氢原子中只有一个电子,故氢原子只有一个轨道
D.原子轨道与电子云都是用来形象描述电子运动状态的
-
下列说法正确的是( )
A. 因为p轨道是“8”字形的,所以p电子是“8”字形
B. 能层数为3时,有3s、3p、3d、3f四个轨道
C. 氢原子中只有一个电子,故氢原子只有一个轨道
D. 原子轨道与电子云都是用来形象描述电子运动状态的
-
下列说法正确的是( )
A. 因为p轨道是“8”字形的,所以p电子是“8”字形
B. 能层数为3时,有3s、3p、3d、3f四个轨道
C. 氢原子中只有一个电子,故氢原子只有一个轨道
D. 原子轨道与电子云都是用来形象描述电子运动状态的
-
下列说法正确的是
A.因为p轨道是“8”字形的,所以p电子走“8”字形
B.第三电子层,有3s、3p、3d三个轨道
C.氢原子中只有1个电子,故氢原子只有一个轨道
D.原子轨道与电子云都是用来形象描述电子运动状态的
-
下列说法正确的是
A.因为p轨道是“8”字形的,所以p电子是“8”字形
B.能层数为3时,有3s、3p、3d、3f四个轨道
C.氢原子中只有一个电子,故氢原子只有一个轨道
D.原子轨道与电子云都是用来形象描述电子运动状态的
-
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。
-
下列各组原子中,彼此化学性质一定相似的是
A.最外层都只有一个电子的X、Y原子
B.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
C.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
D.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
-
(1)X原子在第二电子层上只有一个空轨道,则X是__;其轨道表示式为__;R原子的3p轨道上只有一个未成对电子,则R原子可能是__、 ;Y原子的核电荷数为29,其电子排布式是__,其在元素周期表中的位置是__,是属于__区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:__、__、__。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子__。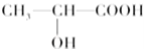
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)__。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4__H2SO3;H3PO4__H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为__杂化,分子的立体构型为__。
BF3分子中,中心原子的杂化方式为__杂化,分子的立体构型为__。
(7)H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于________________。
-
下列说法正确的是
A.因为p轨道是哑铃形的,所以p轨道上的电子也是哑铃形的
B.能层序数为3时,有3s、3p、3d、3f四个轨道
C.氢原子中只有一个电子,故氢原子核外只有一个轨道
D.原子轨道与电子云都是用来形象描述电子运动状态的
-
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后没有未配对电子;C原子的2p轨道上没有空轨道上且电子的自旋方向相同;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)下列元素的名称是:B:________;E:________;
(2)D原子在元素周期表的___________区。
(3)C原子的电子排布图____________________。
(4)B原子的核外价电子排布式________________。