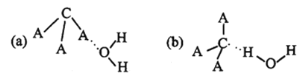-
已知X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y原子核外电子有6种不同的运动状态;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K的+1价阳离子的核外有3层电子且各层均处于全满状态;L位于ds区,它的基态原子的N层上只有2个电子。
请回答下列问题:(答题时,X、Y、Z、W、K、L用所对应的元素符号表示)
(1)ZX5为离子化合物,写出它的电子式_________________。
(2) K的基态原子的电子排布式是______________________。
(3) Y、Z、W元素的第一电离能由大到小的顺序是__________________。
(4)第一电离能I1(L)__I1(K)(填“大于”或“小于”),原因是________________
(5)Y2X4是石油炼制的重要产物之一, 1mol Y2X4分子中含σ键为______mol;
(6)肼(Z2H4)可用作火箭燃料,其原理是:Z2O4(l)+2Z2H4(l)=3Z2(g)+4H2O(g),若反应中有4mol Z-H键断裂,则形成的π键有_________mol.

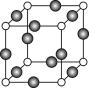
(7)Z、K两元素形成的某化合物的晶胞结构如图所示,则Z原子的配位数是______。
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
已知:A、B、C、D、E、F为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同。
请回答下列问题:
(1)D元素的原子中存在________种运动状态的电子;
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为________(写出2种即可)
(3)与C同族且位于第四周期元素所形成简单气态氢化物的电子式为________;其与C的简单气态氢化物相比稳定性更________(填“强”或“弱”);
(4)F的基态原子核外电子排布式是_____________________________;其在元素周期表中的位置是:_______________________________;
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能________(填“大”或“小”)。
-
已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________(用化学式表示),原因是_____________________。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________。
(3)1 mol B2A2分子中含σ键的数目是____________。
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____个原子,该晶体类型为________。


(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________。
-
周期表前四周期的元素A、B、C、D、E、F,原子序数依次增大,A是周期表中原子半径最小的元素,B的基态原子中只有1个未成对电子,C基态原子中有7种不同运动状态的电子,D的最外层电子数是其所处周期数的3倍,E与D同主族,F的一价阳离子最外层有18个电子。回答下列问题:
(1)F在周期表中的位置是_____________,它的基态原子的电子排布式为_____________
(2)A元素与其他元素形成的含氧酸中,酸根呈三角锥结构的酸是_________,该酸的中心原子的杂化方式为_________
(3)CA3极易溶于水,试从下图中判断CA3溶于水后形成CA3·H2O的合理结构为_____(填字母代号),推理依据是___________
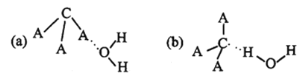
(4)元素B可形成H3BO3,已知H3BO3的电离方程式为H3BO3+2 H2O [B(OH)4]一+H3O+
[B(OH)4]一+H3O+
①基态B、D原子的第一电离能由小到大的顺序为__________(用元素符号表示)
②[B(OH)4]一中B原子的杂化类型为_______________
③写出一种与H3O+互为等电子体的分子的化学式:___________
④H3BO3晶体在热水中的溶解度大于冷水中的溶解度的原因为__________________
-
(Ⅰ)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol C与A元素的最高价氧化物反应时转移的电子数为_________。
(Ⅱ)、某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
(1)按右图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称是_________; 实验过程中,装置B中观察的现象是___________;装置C中有白色沉淀生成,该沉淀是__________(填化学式)。
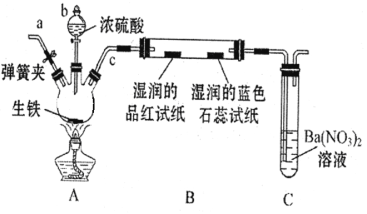
(2)装置A反应容器中还会产生CO2气体,请写出产生CO2的化学方程式__________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是__________。
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为______.
(2)关于B2A2的下列说法中正确的是______.
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是______.
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因______.
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有______ 键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,则M的电子式为______,N的结构式为______.
(6)E的氢化物的价层电子对互斥理论模型为______,E 原 子的杂化方式为______杂化.
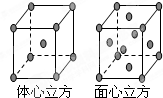
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______,F原子配位数之比为______.
-
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
-
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
-
A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)元素E在周期表中的位置为___________________________;
(2)把D的单质放到NaOH溶液中,反应的化学方程式为:_______________________;
(3)用电子式表示甲的形成过程:_________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,充分振荡并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的体积比为________________;
(5)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:______。