-
PbO2及2PbCO3·Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料。
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到。
①Pb(NO3)2被氧化为PbO2的离子方程式为 。
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq) PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
(2)制备碱式碳酸铅的实验步骤如下:
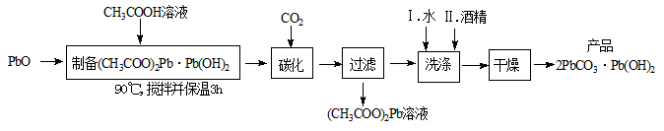
①“碳化”时,发生反应的化学方程式为 。
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 。
(3)为确定2PbCO3·Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示。
①A→B过程中,从体系中逸出的分解产物(化合物)为 (填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为 (填化学式)。
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程)。
-
四氧化三铅(Pb3O4,也可写作2PbO·PbO2)俗名“铅丹”或“红丹”,可用作防锈剂。工业上以废旧铅酸电池的铅膏(主要成分是PbSO4和PbO2)为原料制备Pb3O4的流程如下:
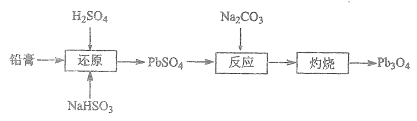
(1)“还原”时的化学方程式为__________。
(2)已知: Ksp[PbCO3]=1.5×10-13。 若使溶液中Pb2+的浓度小于1×10-5 mol/L,此时溶液中的c(CO32-)>_____mol/L。
(3)为测定某样品四氧化三铅含量,称取样品0.1200g,加入足量的6 mol/LHNO3充分溶解,过滤,得到含Pb2+的滤液和PbO2固体。将固体PbO2连同滤纸一并置于另一只锥形瓶中,加入足量的醋酸和醋酸钠混合溶液,再加入过量KI,使PbO2充分氧化I-,以淀粉溶液作指示剂,用0.01000mol/L Na2S2O3溶液滴定,终点时用去30.00mL。已知:I2+ 2 Na2S2O3 = Na2S4O6 + 2NaI。
①所加KI必须过量,原因是_____________________________。
②计算试样中Pb3O4的质量分数____________。(写出计算过程)
-
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
-
(碱式氧化镍 (Ni00H)可用作镍氢电池的正极材料。以含镍(Ni2+ )废液为原料生产 Ni00H的一种工艺流程如下:
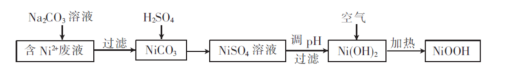
(1)加入Na2C03溶液时,证明Ni2+已经完全沉淀的实验方法是 ,过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式 : 。
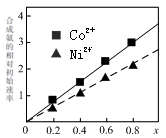
(3)硫酸镍溶液可用于制备合成氨的催化剂C0ni(1-n) Fe204。
如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。
(4)写出在空气中加热Ni(0H)2NK0H)制取Ni00H的化学方程式: 。
-
(12分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
-
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
-
(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
-
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是______________________________,过滤时需用到的玻璃仪器有烧杯、_______________________。
(2)写出碳酸镍与稀硫酸反应的离子方程式:_____________________。
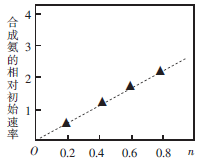
(3)硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n) Fe2 O4。如图表示在其他条件相同时合成氨的相对初始速率随催化 剂中n值变化的曲线,由图分析可知Co2+、 Ni2+两种离子中催化效果更好的是_________。
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________________。
-
下列表示对应化学反应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O===[Al(OH )4]-+4NH
)4]-+4NH
B. 铅酸蓄电池充电时的正极反应:PbO2+4H++SO +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
C.Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-===Fe(OH)3 ↓ + BaSO4↓
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-===Fe(OH)2↓+2NH3·H2O
-
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
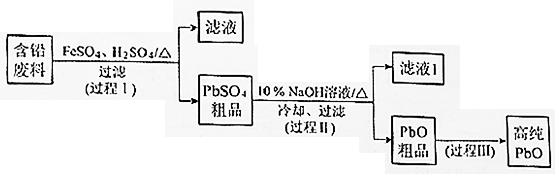
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42−=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
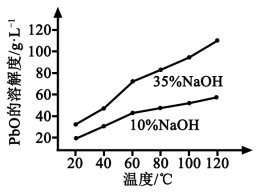
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。











