-
工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质) 制备金属锂,工艺流程如下:
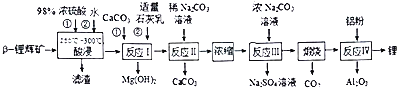
回答下列问题:
(1) β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2) 工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)= 2.5×10-9,Ksp(Li2CO3)= 1.6×10-3,若反应Ⅱ 的溶液中c(Ca2+)和c(Li+)均为1.0 mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4) 反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5) 高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
| c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
| Li 浸出率/% | 30 | 60 | 90 | 80 | 70 |
| Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。
-
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:

已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
-
工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________。
(3)溶液a中加入NaClO的作用为_______________________________。
(4)沉淀A 的成分为__________________。操作2的名称是___________________。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5moI/L,此时溶液中c(Ca2+)最大等于_________mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________。
-
 和
和 都是锂离子电池的电极材料,可利用钛铁矿
都是锂离子电池的电极材料,可利用钛铁矿 主要成分为
主要成分为 ,还含有少量MgO、
,还含有少量MgO、 等杂质
等杂质 来制备,工艺流程如下:
来制备,工艺流程如下:

回答下列问题:
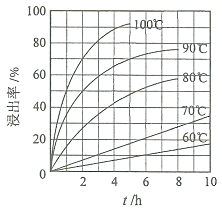
 “酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为
“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为 时,所采用的实验条件为______。
时,所采用的实验条件为______。
 “酸浸”后,钛主要以
“酸浸”后,钛主要以 形式存在,写出相应反应的离子方程式______。
形式存在,写出相应反应的离子方程式______。
 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度 | 30 | 35 | 40 | 45 | 50 |
|  转化率 转化率
| 92 | 95 | 97 | 93 | 88 |
分析 时
时 转化率最高的原因______。
转化率最高的原因______。
 中Ti的化合价为
中Ti的化合价为 ,其中过氧键的数目为______。
,其中过氧键的数目为______。
 若“滤液
若“滤液 ”中
”中 ,加入双氧水和磷酸
,加入双氧水和磷酸 设溶液体积增加1倍
设溶液体积增加1倍 ,使
,使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有
,此时是否有 沉淀生成?______
沉淀生成?______ 列式计算
列式计算 。
。 、
、 的
的 分别为
分别为 、
、
 写出“高温煅烧
写出“高温煅烧 ”中由
”中由 制备
制备 的化学方程式______。
的化学方程式______。
-
(14分)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
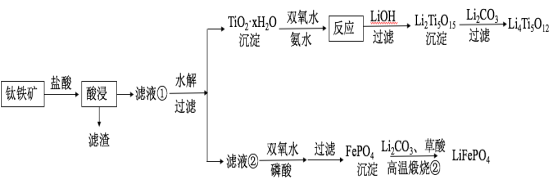
回答下列问题:
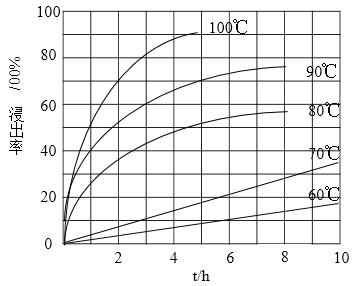
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
-
[2017新课标Ⅰ]Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
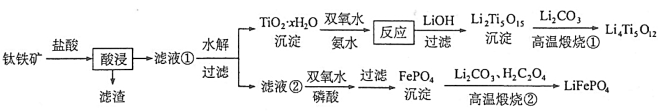
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
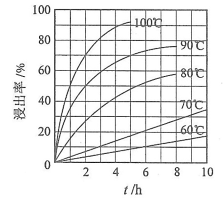
(2)“酸浸”后,钛主要以 形式存在,写出相应反应的离子方程式__________________。
形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为 。
。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
-
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
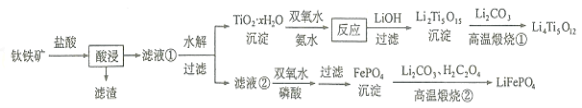
回答下列问题:
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。
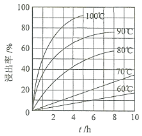
(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为 ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。
-
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
-
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________________________。
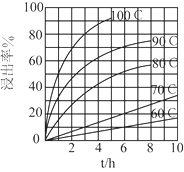
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式____________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为___________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成______________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式____________。
-
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
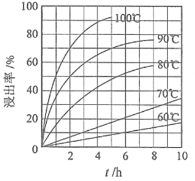
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如上图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为_____________。
(2)“酸浸”后,钛主要以 形式存在,写出相应反应的离子方程式________。
形式存在,写出相应反应的离子方程式________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
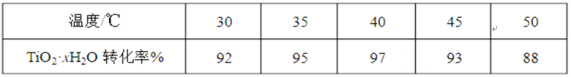
分析40 ℃时TiO2·xH2O转化率最高的原因________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_______。
(5)若“滤液②”中 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有
,此时是否有 沉淀生成? ________(列式计算)。
沉淀生成? ________(列式计算)。 的Ksp分别为
的Ksp分别为
(6)写出“高温煅烧②”中由 制备
制备 的化学方程式___________。
的化学方程式___________。
















