-
近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、NOx等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1)已知:2C(s)+O2(g) 2CO(g) ΔH1= -221.0 kJ/mol
2CO(g) ΔH1= -221.0 kJ/mol
N2(g)+O2(g) 2NO (g) ΔH2= +180.5 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
用焦炭还原NO生成无污染气体的热化学方程式为_________________________________。
(2)已知由CO生成CO2的化学方程式为CO+O2 CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
(3)CO2可用来生产燃料甲醇。CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
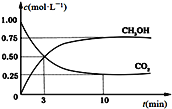
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
②氢气的转化率=________________________。
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入0.5 mol CO2 和1.5 mol H2
C.充入He(g),使体系压强增大 D.将H2O(g)从体系中分离出去
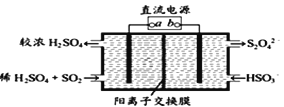
(4)利用如图所示电解装置(电极均为惰性电极)可吸收SO2,并用阴极室排出的溶液吸收NO2 。与电源b极连接的电极的电极反应式为____________________________________。
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
-
近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、氮氧化物等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1) 用CaSO4代替O2与燃料CO反应,是一种高效、清洁、经济的新型燃烧技术,既可提高燃烧效率,又能得到较纯的CO2,以便于被处理。反应①为主反应,反应②和③为副反应。
ⅰ.CaSO4(s)+4CO(g)==CaS(s)+4CO2(g) ΔH1=-189.2 kJ·mol-1
ⅱ.CaSO4(s)+CO(g)==CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
ⅲ.CO(g)== C(s)+
C(s)+ CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)==CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=_________________
(2)已知由CO生成CO2的化学方程式为CO+O2 CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=___________________________________;
②30 min后只改变某一条件,反应达新平衡,根据上表数据判断改变的条件可能是____(选填字母);
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则Q_____0 (填“>”、“=”或“<”)。
(4)利用如图所示电解装置(电极均为惰性电极)也可吸收SO2,并用阴极室排出的溶液吸收NO2。与电源b极连接的电极的电极反应式为____________________________________。

(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
-
近期我国中东部地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野。PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺的有害颗粒。下列有关说法中不正确的是( )
A.PM2.5表面积大,能吸附大量的有毒、有害物质
B.PM2.5在空气中形成了气溶胶
C.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
D.PM2.5主要来自工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质
-
近期我国中东部地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野.PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺的有害颗粒.下列有关说法中不正确的是( )
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成了气溶胶
C.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
D.PM2.5主要业自工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质
-
近期我国中东部地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野。PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺的有害颗粒。下列有关说法中不正确的是
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成了气溶胶
C.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
D.PM2.5主要业自工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有
毒物质
-
近年来我国很多城市发生严重的雾霾天气,对人们的健康造成威胁,下列有关环境问题的说法不正确的是
A.改进汽车尾气净化技术,可以减少大气污染物的排放
B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气产生的主要原因
C.推广燃煤脱硫技术,可以降低S02对大气的污染
D.CO、S02、NO、N02都是对大气产生污染的气体,它们在空气中都能稳定存在
-
近年来我国很多城市发生严重的雾霾天气,对人们的健康造成威胁,下列有关环境问题的说法不正确的是
A.改进汽车尾气净化技术,可以减少大气污染物的排放
B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气产生的主要原因
C.推广燃煤脱硫技术,可以降低S02对大气的污染
D、CO、S02、NO、N02都是对大气产生污染的气体,它们在空气中都能稳定存在
-
近年来我国很多城市发生严重的雾霾天气,对人们的健康造成严重威胁,下列有关环境问题的说法不正确的是
A.改进汽车尾气净化技术,可以减少大气污染物的排放
B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是雾霾天气的主要原因
C.推广燃煤脱硫技术,可以降低SO2对大气的污染
D.CO、SO2.NO、NO2都是对大气产生污染的气体,它们在空气中都能稳定存在
-
2013年冬天,多个地区发生持续大雾天气,“PM2.5”数据监测进入公众视野。“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是( )
A.PM2.5表面积大能吸附大量的有毒、有害物质
B. PM2.5在空气中形成的分散系为胶体
C.实施绿化工程,可以有效地防治PM2.5污染
D.烟、雾属于胶体,能产生丁达尔效应
-
2011年冬天,全国多个地区发生持续大雾天气,“PM2.5”数据监测纳入公众视野。“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是( )
A.雾属于胶体,能产生丁达尔现象
B.持续大雾天气给农业生产、交通运输等带来很大的影响
C.大雾的形成与汽车的尾气排放没有关系
D.空气中悬浮的细小颗粒物严重危害人体健康
2CO(g) ΔH1= -221.0 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。


