-
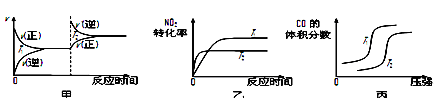
汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,温度不同(T2>T1)、其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,温度不同(T2>T1)、其他条件相同时,下列图像正确的是
A. 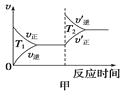 B.
B. 
C. 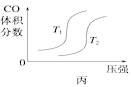 D.
D. 
-
汽车尾气中CO、NO2在一定条件下可以发生反应:4CO(g)+2NO2(g)  4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:
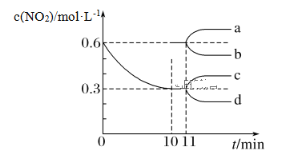
(1)0~10 min内该反应的平均速率v(CO)=________,从11 min起其他条件不变,压缩容器的容积变为1 L,则c(NO2)的变化曲线可能为图中的________(填字母)。
(2)恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填字母)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(3)写出该反应平衡常数表达式:______,增大压强平衡______(填“正向”“不”“逆向”)移动,平衡常数______(填“增大”“减小”“不变”)。
(4)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像表示正确的是_______(填序号)。
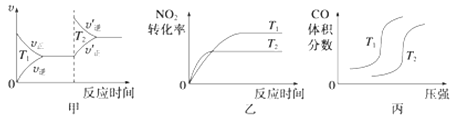
-
一定条件下发生:2NO2(g) + 4CO(g)  4CO2(g) + N2(g) △H<0,能使该反应的反应速率增大,且平衡逆向移动的是
4CO2(g) + N2(g) △H<0,能使该反应的反应速率增大,且平衡逆向移动的是
A. 及时分离出CO2
B. 适当提高温度
C. 减小容器的体积使体系压强增大
D. 选择高效的催化剂
-
污染性气体NO2与CO在一定条件下发生的反应为2NO2(g)+4CO(g)⇌4CO2(g)+N2(g),310K下,向1L的恒温恒容密闭容器中充入0.1mol NO2和0.2mol CO,5min后反应达到平衡,此时NO2的浓度为0.05mol/L。
(1)反应从开始到5min时,CO的平均反应速率v(CO)=________,NO2 的平衡转化率a=________,310K时,上述反应的平衡常数K=________。
(2)在350K下,重复上述实验,平衡后NO2 的物质的量分数为30%,则该反应的ΔH________(填“>”“<“或“=”)0。
-
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体CO2和N2等。
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是______(填代号)。
汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=81。
CO2(g)+H2(g)ΔH<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=81。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
(2)平衡时,甲容器中CO的转化率是 ;平衡时,比较容器中H2O的转化率:乙 甲(填“>”、“<”或“=”,下同);丙 甲。
(3)已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 KJ•mol; CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41 KJ•mol 。贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式是_____________________。
-
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)(1)4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);


(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。
CO2(g)+H2(g) ΔH<0。
820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为___________
②平衡时,甲容器中CO的转化率是 。比较下列容器中CO的转化率:乙 甲;丙 甲(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度 (填“升高”或“降低”),平衡常数K (填“增大”、“减小”或“不变”)。
-
目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)  4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________ 填字母代号
填字母代号 。
。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2V逆(NO2)=V正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
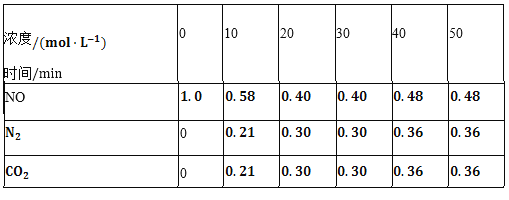
①根据表中数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)________;计算该反应的平衡常数 ________。
________。
②根据上表数据判断,由30min到40min时改变的条件可能是________ 任写一种
任写一种 。
。
③若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,此时NO的转化率________ 填“升高”或“降低”
填“升高”或“降低” ,△H________
,△H________ 填“
填“ ”或“
”或“ ”
” 。(3)以
。(3)以 与
与 为原料可合成化肥尿素化学式为
为原料可合成化肥尿素化学式为 。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
-
汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
A. 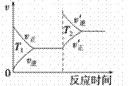 B.
B. 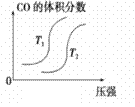 C. C
C. C D.
D. 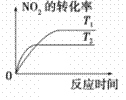
-
汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
A.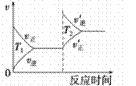 B.
B.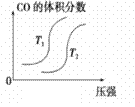 C.C
C.C D.
D.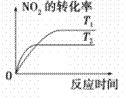
-
汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g) 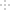 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
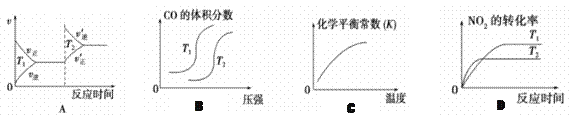
A. A B. B C. C D. D
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:


 B.
B. 
 D.
D. 



 B.
B.  C. C
C. C
 B.
B. C.C
C.C
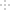 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是