-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为 。
②已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131 kJ·mol-1,
则C(s)+CO2(g)=2CO(g) ΔH= 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391
mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391 .55 kJ·mol-1。则N
.55 kJ·mol-1。则N 2(g)+3H2(g)=2NH3(g) ΔH= 。
2(g)+3H2(g)=2NH3(g) ΔH= 。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
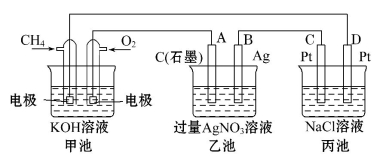
(1)甲池是 装置,乙装置中电极A的名称 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中电极B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH= 。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:

(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g) NH3(g) ΔH =______________。
NH3(g) ΔH =______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。
(4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________
ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
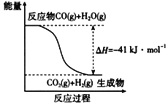
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g) NH3(g) ΔH =______________。
NH3(g) ΔH =______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。
(4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________
ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
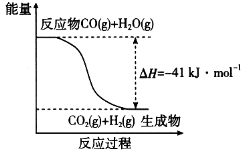
反应的热化学方程式为____________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ•mol−1,H—H键的键能是436.0 kJ•mol−1, N—H键的键能是391.55 kJ•mol−1,则 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)
NH3(g)
ΔH=_____________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g) CO2(g) ΔH1=−393.5 kJ•mol−1
CO2(g) ΔH1=−393.5 kJ•mol−1
② 2H2(g)+O2(g) 2H2O(l) ΔH2=−571.6 kJ•mol−1
2H2O(l) ΔH2=−571.6 kJ•mol−1
③ 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) ΔH3=−2599 kJ•mol−1
4CO2(g)+2H2O(l) ΔH3=−2599 kJ•mol−1
298 K时反应2C(s,石墨)+H2(g) C2H2(g)的焓变:ΔH=_____________________。
C2H2(g)的焓变:ΔH=_____________________。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g) 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是_____________。
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为____________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ•mol−1,H—H键的键能是436.0 kJ•mol−1,N—H键的键能是391.55 kJ•mol−1,则 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH=_____________________。
NH3(g) ΔH=_____________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)  CO2(g) ΔH1=−393.5 kJ•mol−1;②2H2(g)+O2(g)
CO2(g) ΔH1=−393.5 kJ•mol−1;②2H2(g)+O2(g)  2H2O(l) ΔH2=−571.6 kJ•mol−1;③2C2H2(g)+5O2(g)
2H2O(l) ΔH2=−571.6 kJ•mol−1;③2C2H2(g)+5O2(g)  4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1。298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1。298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g)  2Al2O3(s) ΔH1;4Fe(s)+3O2(g)
2Al2O3(s) ΔH1;4Fe(s)+3O2(g)  2Fe2O3(s) ΔH2。下面关于ΔH1、ΔH2的比较正确的是________。
2Fe2O3(s) ΔH2。下面关于ΔH1、ΔH2的比较正确的是________。
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
-
Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________

(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
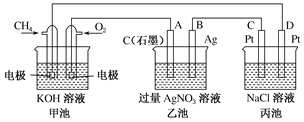
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
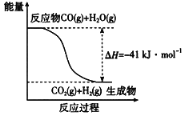
反应的热化学方程式为____________________________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH=______________。
NH3(g) ΔH=______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g) CO2(g) ΔH1=-393.5kJ·mol-1
CO2(g) ΔH1=-393.5kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) ΔH2=-571.6kJ·mol-1
2H2O(l) ΔH2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
298K时反应2C(s,石墨)+H2(g) C2H2(g)的焓变:ΔH=_______________。
C2H2(g)的焓变:ΔH=_______________。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g) 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示,反应的热化学方程式为____________________________________________。

(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,1mol N4生成N2的ΔH=_________ kJ·mol-1

(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。298K时,已知:
①C(s,石墨)+O2(g) CO2(g) ΔH1=a kJ·mol-1
CO2(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) ΔH2=b kJ·mol-1
2H2O(l) ΔH2=b kJ·mol-1
③2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
则反应:2C(s,石墨)+H2(g) C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g) 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是____________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法比较
-
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)=NH3(g)ΔH=___________________。
-
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:

①反应的热化学方程式为____________________________________________。
②已知:

则

(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) == NH3(g) ΔH = 。
(3)下图是一个化学过程的示意图:(已知电解质溶液均过量)

①甲装置中通入CH4的电极反应式为
②一段时间,当丙池中产生11.2L(标准状况下)气体时,则乙池中产生气体的物质的量为 ,若要使丙池恢复电解前的状态,应向丙池中加入 。


CO2(g) ΔH1=a kJ·mol-1
2H2O(l) ΔH2=b kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
2Al2O3(s) ΔH1
2Fe2O3(s) ΔH2











