-
(11 分)无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)加入焦炭后的化学反应可表示为Al2O3+C+Cl2  AlCl3+X↑,设计实验确定气体X的成分:__________。
AlCl3+X↑,设计实验确定气体X的成分:__________。
(2)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为____________________。
(3)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式___________________、_______________。
②AlCl3产品的纯度为__________________________________。
-
无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)Cl-的电子式为 ________。Al在元素周期表最中的位置是________。
(2)生产中加入石油焦,其目的是_____________________________________。
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2  AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
____________________________________________________________。
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为 _____________________________________________________________。
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________、___________。
②AlCl3产品的纯度为__________________________________。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式__________________。
-
无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
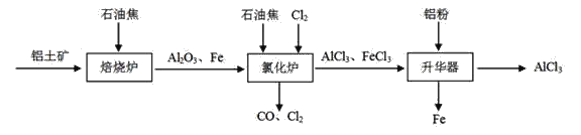
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
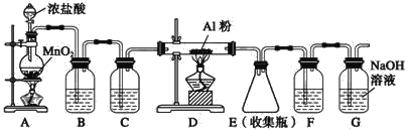
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
-
无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是C)为原料制备无水AlCl3的工艺(碳氯化法)流程如下:
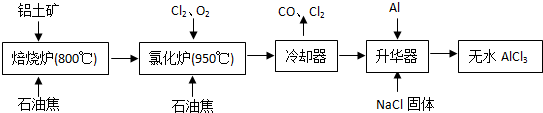
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为______ 2A1C13+3CO
-
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________,实验室配制氯化铝溶液时加入盐酸的目的是________________________。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________ 炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________。计算该样品中Al的质量分数________(结果用m、n表示,不必化简)。
-
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要
成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
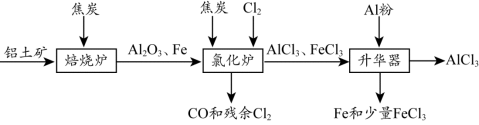
已知:AlCl3、FeCl3 分别在183℃、315℃时升华
(1)Cl2的电子式 。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为 ;炉气中残余的少量Cl2,可用NaOH溶液吸收,其离子方程式为 。
(3)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围 。
a. 低于183℃ b. 介于183℃和315℃之间 c. 高于315℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。

计算该样品中AlCl3的质量分数 (结果用m、n表示,不必化简)。
-
无水AICl3可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:

(1)在焙烧炉中发生反应:①Fe2O3(S) +3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g).
2Fe(s)+3CO2(g).
则反应②的平衡常数的表达式为K= ________。
(2)Al2O3、Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移________mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:________。
(3)升华器中发生反应的化学方程式为 ________。
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AICl3,此反应必须在氯化氢的气流中加热,其原因是________。
已知SOCl2为无色液体且极易与水反应生成HC1和SO2,AlC13·6H2O与SOCl2混合加热可制取无水AlCl3,写出该反应的化学方程式:________。
-
(2016·银川模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2 4AlCl3+3O2。
4AlCl3+3O2。
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是_____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2AlCl3+X↑,设计实验确定气体X的__________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:
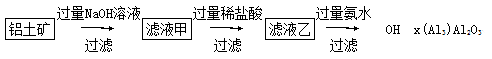
①写出滤液甲中溶质的化学式:___________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:__________________________。
③要进一步获得金属铝,工业上采用的冶炼方法是_______________,
有关反应的化学方程式为________________________。
-
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
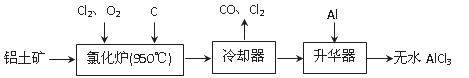
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
-
(14分)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
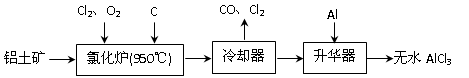
(1)氯化炉中Al2O3、C12和C反应的化学方程式为▲。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为▲。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是▲。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式▲ 、▲ 。
②AlCl3产品的纯度为▲。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是▲ 。
AlCl3+X↑,设计实验确定气体X的成分:





 NaAlO2溶液
NaAlO2溶液




