-
氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间1 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的化学方程式:2N2(g)+6H2O(l)  4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1
回答下列问题:
(1)此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
(2)已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1
2H2(g)+O2(g) ===2H2O(l) ΔH =-571.6 kJ·mol-1
则2N2(g)+6H2O(l)===4NH3(g)+3O2 (g) ΔH=________kJ·mol-1
(3)从323 K到353 K,氨气的生成量减少的可能原因_________________;
(4)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92 .4 kJ·mol-1 ,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1 ,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
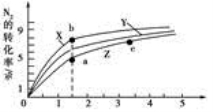
①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点H2的转化率最小的是________点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)  N2(g)+3H2(g)的平衡常数为________ 。
N2(g)+3H2(g)的平衡常数为________ 。
-
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气:

该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,
B.反应达到平衡后,
C.体系的总压强不变,说明反应已达平衡
D.混合气体的密度保持不变,说明反应已达平衡
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
 ①
①
 ②
②
 ③
③
请写出上述三个反应中 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式, =_________。
=_________。
(3)工业制硝酸的主要反应是:
 =
=
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
| 时间/浓度 | 

| 

| 

| 

|
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | a | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
-
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
① 此合成反应的a________0 (填“>”“<”或“=”)
② 已知:
N2 (g) + 3H2(g) 2NH3 (g) ΔH=-92.4 kJ·mol-1,
2NH3 (g) ΔH=-92.4 kJ·mol-1,
2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6 kJ·mol-1,
则2N2 (g) + 6H2O (l) 4NH3 (g) + 3O2 (g) ΔH=________;
4NH3 (g) + 3O2 (g) ΔH=________;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是________(填字母标号)

II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g) 2SO3 (g) ΔH=-196.0 kJ·mol-1
2SO3 (g) ΔH=-196.0 kJ·mol-1
① 容器体积不变时,为了提高SO2的转化率,可采用的措施是________(填字母标号)
A.加入V2O5作催化剂 B.使用过量SO2 C.高温 D.通入过量空气
② 某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是________,该温度下的平衡常数K=________;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将________(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将________。
-
Ⅰ.化学平衡知识:
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g) ΔH=1530 kJ/mol,
4NH3(g)+3O2(g) ΔH=1530 kJ/mol,
H2O(g)=H2O(1)ΔH=-44.0kJ/mol,
则4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=______kJ/mol。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____(填字母)
2N2(g)+6H2O(g) ΔH=______kJ/mol。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g) CO(NH2)2+H2O(g)ΔH<0,某温度下,向容器为1L 的密闭容器中通入4molNH3 和2molCO2,该反应进行到40% 时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3 的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线____________
CO(NH2)2+H2O(g)ΔH<0,某温度下,向容器为1L 的密闭容器中通入4molNH3 和2molCO2,该反应进行到40% 时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3 的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线____________
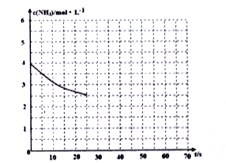
②若保持温度和容器体积不变,向平衡体系中再通入2molNH3 和2molH2O,此时v正____v 逆(填“>”、“=”或“<”)
(3)羟胺NH2OH 可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______.
Ⅱ.溶液中的行为:
(4)常温下,向20 mL 0.2 mol/LH2A 溶液中滴加0.2 mol/LNaOH 溶液。有关微粒物质的量变化如下图所示。
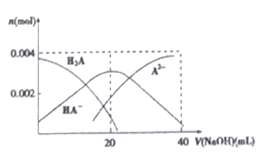
则当v(NaOH)=20mL 时,溶液中离子浓度大小关系:____________.
(5)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
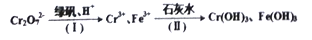
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为___________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol/L,则残留的Cr3+的浓度为______。(已知:Ksp[Fe(OH)3 ]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
-
氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)  H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)  H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
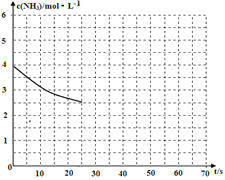
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
-
科学家一直致力于“人工固氮”的新方法研究。
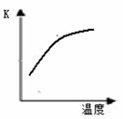
(1)最新“人工固氮”的研究报道:常温常压.光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O (l)  4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q
已知该反应的平衡常数K与温度的关系如右图,则此反应的 Q 0 (填“>”“<”或“=”)。
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________ (选填编号)。
A.容器中气体的平均分子量不随时间而变化 B.v(N2)/ v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水。用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是 (填字母标号)。
A.c(H+)×c(NH3·H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在右图中画出正(v正).逆(v逆)反应速率随时间t变化的示意图。
-
科学家一直致力于“人工固氮”的新方法研究.最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2(g)+6H2O(l) 4NH3 (g)+3O2(g)△H=a kJ•mol-1
4NH3 (g)+3O2(g)△H=a kJ•mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a______0 (填“>”“<”或“=”)
(2)用水稀释0.1mol•L-1氨水,溶液中随着水量的增加而减小的是______(填字母标号)
A. B.
B. C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D.
(3)氨可用于工业制硝酸,其主反应为:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0
若此反应起始的物质的量相同,则下列关系图正确的是______(填序号)
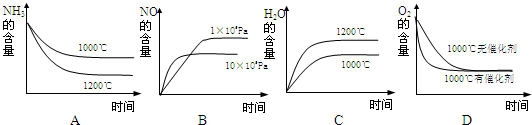
(4)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
①反应在第2min到第4min时,O2 的平均反应速率为______mol/
②反应在第2min到第4min时改变了条件,改变的条件可能是______.
③在第6min到第8min时,改变了反应的条件,该平衡向______移动(填“左”或“右”).
-
最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O (l)  4NH3 (g)+3O2 (g) △H= – Q(Q>0) ,如果反应的平衡常数K值变大,该反应( )
4NH3 (g)+3O2 (g) △H= – Q(Q>0) ,如果反应的平衡常数K值变大,该反应( )
A.化学平衡一定向正反应方向移动
B.化学平衡一定向逆反应方向移动
C.在平衡移动时正反应速率增大逆反应速率减小
D.在平衡移动时正反应速率增大逆反应速率不变
-
最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) – Q(Q>0) ,如果反应的平衡常数K值变大,该反应
4NH3 (g)+3O2 (g) – Q(Q>0) ,如果反应的平衡常数K值变大,该反应
A. 一定向正反应方向移动
B. 一定向逆反应方向移动
C. 在平衡移动时正反应速率先减小后增大
D. 在平衡移动时逆反应速率先增大后减小
-
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g) △H=+765.2 kJ/mol (I)
请回答下列问题:
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议: 。
(3)写出工业上用H2和N2直接合成NH3的化学方程式 ,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为 ;反应的平衡常数K= (不要求写单位)。
4NH3(g)+3O2(g)ΔH=a kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1 ,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:

N2(g)+3H2(g)的平衡常数为________ 。