-
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
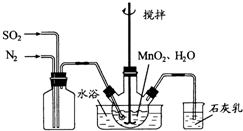
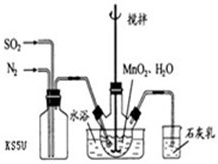
在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+ H2SO3= MnSO4+H2O)。
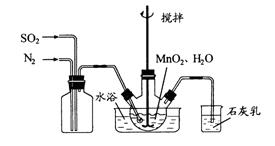
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
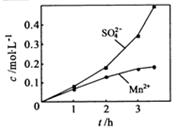
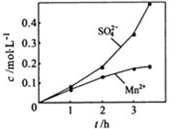
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如下图。
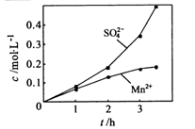
导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入 ,并控制溶液pH ;
② ;
③检验SO42-是否被洗涤干净;(实验操作: )
④用少量C2H5OH洗涤;
⑤ 。
-
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤.
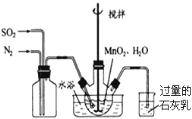
① 写出左边集气瓶的作用 。
② 石灰乳的作用是: (用化学方程式表示)
③ 写出MnO2和H2SO3反应的离子反应方程式 。
④反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 (选择选项填空)。
a.缓慢通入混合气体 b.快速通入混合气体c.控制适当的温度 d.高温加热
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化, 100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂: Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】。
100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂: Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】。
① 边搅拌边加入Na2CO3,并控制溶液pH<7.7;
② ;
③ 检验SO42-是否被洗涤干净。检验水洗是否合格的方法是 。
④ 用少量C2H5OH洗涤,其目的是 ;
⑤ 低于1 00℃干燥。
00℃干燥。
-
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
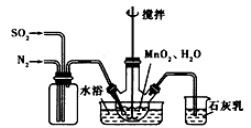
(1)制备MnSO4溶液:在烧瓶中(装置见上图)加入一定量MnO2和水,搅拌,通人SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤。
①写出反应方程式:MnO2+ H2SO3=_________________;
石灰乳参与反应的化学方程式为___________________。
②反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(填两种)________________、___________________。
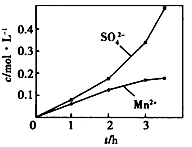
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异,其中Mn2+对O2与H2SO3反应所起的作用是_________________。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH= 7.7。
请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2O 、Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入_________________,并控制溶液pH_______7.7;
②_______________________;
③_______________________;
④_______________________;
⑤低于100℃干燥。
-
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳参与反应的化学方程式为______.
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有______、______.
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是______.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①______;②______;③______;④______;⑤低于100℃干燥.
-
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳作用________.
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是________.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①________;②________;③检验SO42-是否被洗涤除去;④________;⑤低于100℃干燥.
Ⅱ锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于
250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,
用0.01100mol⋅L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是________.
(2)计算合金中Cu的质量分数________.
-
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下.

(1)制备MnSO4溶液:在烧瓶中(装置见图1)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入O2,继续反应片刻,过滤(已知MnO2+H2SO3═MnSO4+H2O).
①石灰乳参与反应的化学方程式为 .
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 .
③若实验中将N2换成空气,测得反应液中Mn2+、SO42﹣的浓度随反应时间t变化如图2导致溶液中Mn2+、SO42﹣浓度变化产生明显差异的原因是 .
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤
实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH.
①边搅拌边加入 ,并控制溶液pH ;
② ;
③检验SO42﹣是否被洗涤干净;(实验操作: )
④用少量C2H5OH洗涤;
⑤ .
-
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下所示:
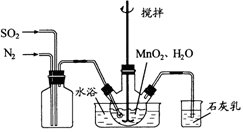
Ⅰ.制备MnSO4溶液:
在三颈烧瓶中加入4.35gMnSO4和足量的水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤、洗涤,得MnO2溶液。(N2不参与反应)
(1)制取MnSO4的化学方程式为_______________.
(2)反应过程中,为使SO2尽可能转化完全,在不改变固液投料的条件下,可采取的合理措施有________________.
(3)水浴加热的优点是____________。
Ⅱ.制备高纯MnCO3固体:
已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;pH=7.7时Mn(OH)2开始沉淀。
实验步骤: ①将所得MnSO4溶液与20.0mL 2.0mol/L的Na2CO3溶液混合,充分反应;②过滤,用少量水洗涤2~3次 ;③用少量C2H5OH洗涤;④低温 (低于100℃) 干燥,得固体3.45g。 (1) MnSO4溶液与Na2CO3溶液混合的正确操作为__________。(填字母代号)
a. 将Na2CO3溶液缓慢滴加到MnSO4溶液中,边加边搅拌
b. 将MnSO4溶液缓慢滴加到Na2CO3溶液中,边加边搅拌
c. 将Na2CO3溶液迅速倒入到MnSO4溶液中,并充分搅拌
d. 将MnSO4溶液迅速倒入到Na2CO3溶液中,并充分搅拌
(2)检验MnCO3固体是否洗涤干净的方法为______________。
(3) 用少量C2H5OH洗涤的目的是_______________。
(4) MnCO3的产率为_____________。
-
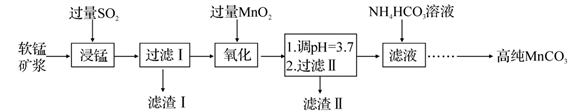
工业以软锰矿(主要成分是 MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
已知:25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH 如下表所示。
| 金属阳离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)“浸锰”过程中 Fe2O3与SO2反应的离子方程式为 Fe2O3+SO2+2H+ =2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
写出ⅱ的离子方程式:_______________________。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_________ (填离子符号)。
(3)写出“氧化”过程中MnO2 与Fe 2+反应的离子方程式:___________。
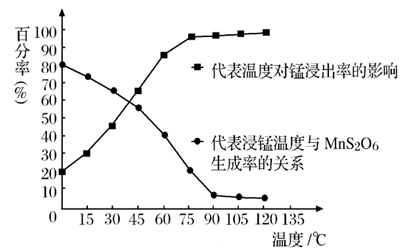
(4)“浸锰”反应中往往有副产物 MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是;_____滤渣Ⅱ的成分是______ (写化学式);向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度不宜太高的原因是______________。
(5)加入NH4HCO3溶液后,生成 MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:__________________ 。
(6)生成的 MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________。
-
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
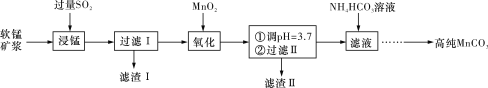
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
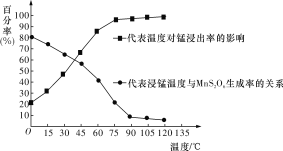
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
-
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
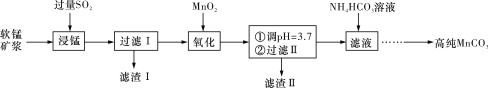
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
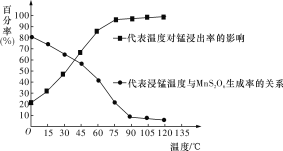
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
















