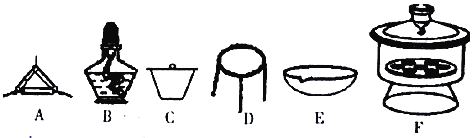-
碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为,Mg(OH)2∙4MgCO3∙5H2O某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案Ⅰ
取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
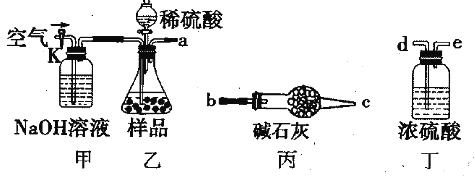
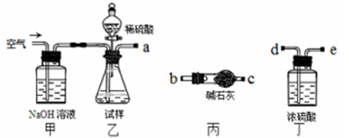
(1)乙中发生反应的方程式为____________________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a________ ,丁的作用是____________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是__________________________。
方案Ⅱ
①称取碱式碳酸镁样品m克;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1克。
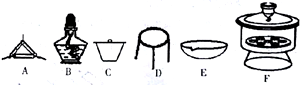
(4)下列仪器中,该方案不会用到的是______________________。
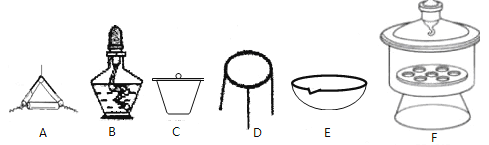
(5)判断样品完全分解的方法是_______________________。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3+SiO2  MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
(7)求碱式碳酸镁的纯度_______________________(用含有m,m1的式子表示)
-
碱式碳酸镁可用于生产牙膏、医药和化妆品等,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁样品中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个
方案:
方案I 取一定质量的样品,与稀硫酸充分反应,通过测定生成CO2的质量计算纯度。
(1)乙中发生反应的化学方程式为___________________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a→_____,丁的作用是____________。
(3)当样品充分反应后,缓慢通入空气的目的是____________________________。
方案II①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g。
(4)下列仪器中,该方案不会用到的是__________(填标号)。
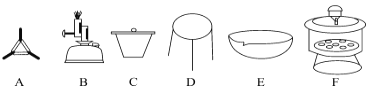
(5)判断样品完全分解的方法是________________。
(6)有同学认为方案II高温煅烧的过程中会发生MgCO3+SiO2 MgSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______(填“正确”或“错误”)。请说明理由:________________________________。
MgSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______(填“正确”或“错误”)。请说明理由:________________________________。
-
碱式碳酸镁可用于牙膏、医药化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。某兴趣小组设计了如下两个方案:
方案I:
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度
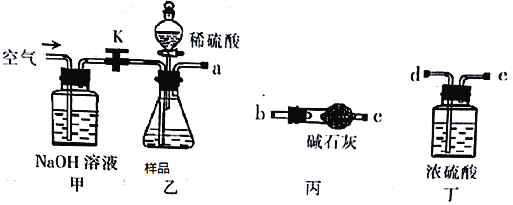
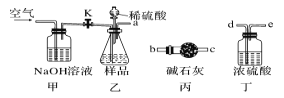
(1)乙中发生反应的方程式为______________________________ 。
(2)仪器接口的连接顺序为(装置可以重复使用) a__________,丁的作用是_________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是______________________________。
方案Ⅱ:
①称取碱式碳酸镁样品mg;②将样品充分高温灼烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
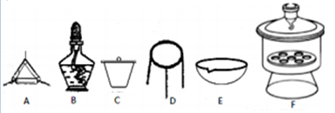
(4)下列仪器中,该方案不会用到的是____________。
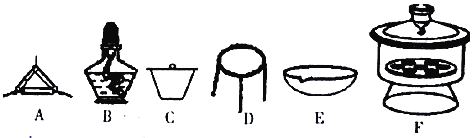
(5)有同学认为方案Ⅱ高温灼烧的过程中会发生MgCO3+SiO2 MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点是否正确_____,(填“正确”或“错误”)请说明自己的理由:______________________。
MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点是否正确_____,(填“正确”或“错误”)请说明自己的理由:______________________。
-
碱式碳酸镁可用于牙膏、医药化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。某兴趣小组设计了如下几个方案:
方案1
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度
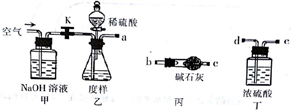
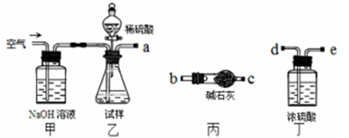
(1)乙中发生反应的方程式为______________________________ 。
(2)仪器接口的连接顺序为(装置可以重复使用) a___________,丁的作用是__________________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是______________________________。
方案Ⅱ
①称取碱式碳酸镁样品mg;②将样品充分高温燃烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
(4)下列仪器中,该方案不会用到的是____________。
(5)判断样品完全分解的方法是_________________________。
(6)有同学认为方案Ⅱ高温燃烧的过程中会发生
会导致测定结果有误,你任为这位同学的观点正确吗?_________,(填“正确”或“错误”)
请说明自己的理由:______________________。
-
碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。
(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2 MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
-
碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2 MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
-
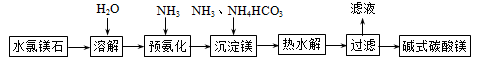
碱式碳酸镁不溶于水,用途广泛,主要用作橡胶制品的填充剂,能增强橡胶的耐磨性和强度。也可用作油漆和涂料的添加剂,也可用于牙膏、医药和化妆品等工业。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:

(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Ksp(Mg(OH)2)=1.8×10-11,表示Mg(OH)2沉淀溶解平衡的方程式为_______________,Mg(OH)2达到沉淀溶解平衡时溶液的pH______(已知:lg36≈1.5)。
(2)已知:常温下Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11,Kb(NH3·H2O)=1.8×10-5,则NH4HCO3溶液显________性,c(NH4+)________c(HCO3-)(选填“大于”、“小于”、“等于”),该溶液物料守恒表达式为________________。
(3)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____________。
(4)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁晶体4.84 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO20.896 L,则碱式碳酸镁的化学式为________________,写出氯化镁、氨、碳酸氢铵热水解生成碱式碳酸镁的离子方程式________________________。
-
碱式碳酸镁不溶于水,用途广泛,主要用作橡胶制品的填充剂,能增强橡胶的耐磨性和强度。也可用作油漆和涂料的添加剂,也可用于牙膏、医药和化妆品等工业。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:

(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Ksp(Mg(OH)2)=1.8×10-11,表示Mg(OH)2沉淀溶解平衡的方程式为 ,Mg(OH)2达到沉淀达到沉淀溶解平衡时溶液的pH (已知:lg36≈1.5)。
(2)已知:常温下Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11,Kb(NH3·H2O)=1.8×10-5,则NH4HCO3溶液显 性,c(NH) c(HCO)(选填“大于”、“小于”、“等于”),该溶液物料守恒表达式为 。
(3)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____________。
(4)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁晶体4.84 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,则碱式碳酸镁的化学式为 ,写出氯化镁、氨、碳酸氢铵热水解生成碱式碳酸镁的离子方程式 。
-
碱式碳酸镁不溶于水,用途广泛,主要用作橡胶制品的填充剂,能增强橡胶的耐磨性和强度。也可用作油漆和涂料的添加剂,也可用于牙膏、医药和化妆品等工业。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Ksp(Mg(OH)2)=1.8×10-11,表示Mg(OH)2沉淀溶解平衡的方程式为 ,Mg(OH)2达到沉淀达到沉淀溶解平衡时溶液的pH (已知:lg36≈1.5)。
(2)已知:常温下Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11,Kb(NH3·H2O)=1.8×10-5,则NH4HCO3溶液显 性,c(NH) c(HCO)(选填“大于”、“小于”、“等于”),该溶液物料守恒表达式为 。
(3)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____________。
(4)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁晶体4.84 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,则碱式碳酸镁的化学式为 ,写出氯化镁、氨、碳酸氢铵热水解生成碱式碳酸镁的离子方程式 。
-
镁的单质及其化合物在储氢及大气治理等方面用途非常广泛。
I.工业上可以采用热还原法制备金属镁(沸点1107℃,熔点648.8℃)。 将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先 升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体)。
(1)用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是____________。
(2)碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:_____________。

II.工业上利用纳米MgH2和LiBH4组成的体系储放氢(如题图所示)。
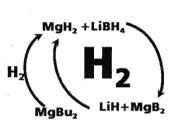
(3)写出放氢过程中发生反应的化学方程式:___________。
III.工业上MgO浆液是高活性的脱硫剂,常用来脱除烟气中的SO2。主要包含的反应有: ① Mg(OH)2+ SO2=MgSO3+H2O ② MgSO3+SO2+H2O= Mg(HSO3)2 ③ Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O ④ 2MgSO3+O2=2MgSO4
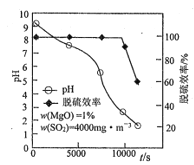
脱硫时,MgO的脱硫效率、pH及时间的关系如题图所示。
己知20℃时,H2SO3的K1=l.54×10-2,K2=1.02×10-7,25℃时,Ksp[MgSO3]= 3.86×10-3,Ksp(CaSO3)= 3.1×10-7。
(4)脱硫过程中使浆液pH减小最显著的反应是______________(填①、②、③或④)。
(5)约9000s之后,脱硫效率开始急速降低,其原因是______________。
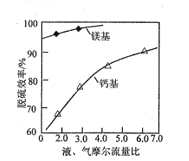
(6)其他条件相同时,镁基和钙基脱硫效率与液、气摩尔流量比如题图所示。镁基脱硫效率总比钙基大,除生成的MgSO4具有良好的水溶性外,还因为______________。


MgSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______(填“正确”或“错误”)。请说明理由:________________________________。