-
有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_________,Cl−的物质的量浓度为________。
(2)8 g NaOH溶于_________g水中,才能使每10个水分子中溶有一个钠离子。
(3)49 g H2SO4中含__________mol原子,含__________个质子。
(4)标准状况下,2. 4 g某气体的体积为672 mL,则此气体的相对分子质量为_________。
(5)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14. 5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为___________
-
有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)0.5 mol CH4的质量是_______g,在标准状况下的体积为________L;含有_____mol电子。
(2)相同物质的量的SO2和SO3,质量之比为_________所含O的物质的量之比为_______ 。
(3)用58.5g无水氯化钠配制成1 L溶液,其物质的量浓度为______ mol/L;若从中取出500 mL,其物质的量浓度为________ mol/L;
(4) 标准状况下,33.6 L的HCl气体所具有的物质的量为_____________,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为__________。
(5)配制100 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为________ mL。
-
有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)标准状况下,①6.72 L NH3 ②1.204×1023个 H2S ③5.6 g CH4 ④0.5 mol HCl ,下列关系按由大到小排序
A.体积大小:___________________ B.质量大小:________________
C.密度大小:___________________D.原子数目:_________________
(2)标准状况下,33.6 L的HCl所具有的物质的量为_____________,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为__________。
(3)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________
(4)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_________
(5)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_________,Cl−的物质的量浓度为________
(6)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等
相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为___________
在0℃和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是________L
若1gN2含a个原子,则阿伏加德罗常数可表示为_____________
由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO )= 0.6 mol/L,则c(K+)为________
)= 0.6 mol/L,则c(K+)为________
-
有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)相同质量的SO2、SO3的物质的量之比为_______,氧原子的个数之比为________。
(2)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等(NA表示阿佛加德罗常数)。
(3)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为______。
(4)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是__________mol。
(5)100 mL 1.0 mol·L-l 稀硫酸与300 mL 1.0 mol·L-l BaCl2溶液混合,所得溶液中H+ 的物质的量浓度为____(忽略混合时溶液体积的变化).
(6)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl— 的物质的量为____mol.
(7)已知4 mol·L-l 的硫酸溶液密度为ρ1,2 mol·L-l 的硫酸溶液密度为ρ2。100g浓度为4 mol·L-l 的硫酸溶液与____mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含ρ1、ρ2的式子表示).
-
完成以下的填空
(1)现有1mol/LCaCl2溶液0.5L,Ca2+所具有的物质的量为____________,Cl-的物质的量浓度为___________
(2)标准状况下,33.6L的HCl所具有的物质的量为_____________,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为__________.
(3)8gNaOH溶于_________g水中,才能使每10个水分子中溶有一个钠离子
(4)49gH2SO4中含__________mol原子,含__________个质子
(5)标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为_________
-
在 2L 由 NaCl、MgCl2、CaCl2 组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A.3.0mol B.2.0mol C.1.0mol D.0.5 mol
-
在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示, 则溶液中Ca2+的物质的量浓度为
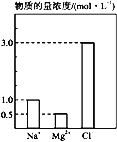
A. 0.5 mol·L-1 B. 1 mol·L-1
C. 1.5 mol·L-1 D. 无法计算
-
在 2L 由 NaCl、MgCl2、CaCl2 组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A. 3.0mol B. 2.0mol C. 1.0mol D. 0.5 mol
-
在2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A. 0.5 mol B. 1.0 mol C. 2.0 mol D. 3.0 mol
-
(16分)实验室制配0.5 mol/L的NaOH溶液500 mL,完成下列实验并回答问题。(每空2分)
⑴配制时,一般可分为以下几个步骤,请填空:
①计算:计算实验需要的NaOH固体质量为________g;
②称量:用小烧杯和托盘天平迅速准确称量所需的NaOH固体
③溶【解析】
往装有NaOH的小烧杯中加入适量的水溶解,冷却至室温
④转移:将上述冷却后的溶液转入500mL的容量瓶
⑤洗涤:用蒸馏水洗涤小烧杯和玻璃棒2-3次,将洗涤液一并注入容量瓶,轻轻摇动使混合均匀
⑥定容:在容量瓶中继续加水至距刻度线1-2cm处,改用________(仪器名称)滴加至凹液面与刻度线相切
⑦摇匀:把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,混合均匀
⑵容量瓶在使用前,必须进行的操作是:________。
⑶实验两次用到玻璃棒,其作用分别是: ________ ________、 ________ ________。
⑷ 试分析下列操作对所配溶液的浓度有何影响。(填“偏高”、“偏低”或“无影响” )
①定容摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响___ 。
②某同学定容时俯视刻度线,则所配制的溶液的浓度_________。
③NaOH溶解后未冷却立即转移到容量瓶中并洗涤定容,则所配制的溶液浓度________。
)= 0.6 mol/L,则c(K+)为________



