-
亚硝酸钠广泛用于印染漂白、食品等行业,常作媒染剂、漂白剂、食品添加剂等。某兴趣小组用下列装證制备NaNO2。
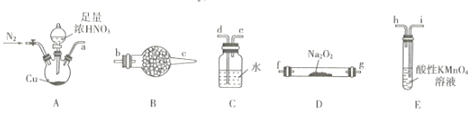
已知:①2NO+Na2O2=2NaNO2; ②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________ ( 按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为____,装置C的作用是_______。
(4)装置E中发生反应的离子方程式为_____________。
(5)为测定亚硝酸钠的含量,称取3.000g样品溶于水配成500mL.溶液,量取25.00mL溶液于锥形瓶中,硫酸酸化后加入过量KI,发生反应:2NO2-+2I-+4H+=2NO↑+I2+2H2O(杂质不参与反应)。然后用0.1000mol/LNa2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=S4O62-+2I-),消耗20.00mL。
①该实验可选用的指示剂为_____,达到滴定终点时的现象是__________。
②所得样品中亚硝酸钠的质量分数为____________。
③下列操作会导致测定结果偏高的是_______(填代号)。
a.滴定过程中向锥形瓶中加少量水
b.消定前滴定管尖嘴部分有气泡,滴定后气泡消失
c.读数时,滴定前仰视,滴定后府视
d.滴定时,标准被滴到锥形瓶外
-
亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。在漂白、电镀等方面应用也很广泛。某兴趣小组设计了如下图所示的装置制备NaNO2(A中加热装置已略去)。
已知:室温下,①2NO+Na2O2===2NaNO2
②酸性条件下,NO 或NO2-都能与MnO4-反应生成NO3-和Mn2+
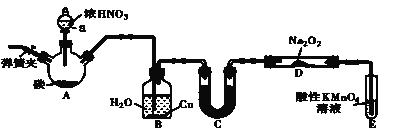
(1)A中发生反应的化学方程式为_________________________________。
(2)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N 2的作用是______________。
(3)装置B中观察到的主要现象为_________________
(4)①为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是___________(填字母序号)。
A.P2O5 B.无水CaCl2 C.碱石灰 D.浓硫酸
②如果取消C装置,D中固体产物除NaNO2外,可能含有的副产物有________ 写化学式)。
(5)E中发生反应的离子方程式为____________。
(6)将1.56g Na2O2完全转化为NaNO2,理论上至少需要木炭__________g。
-
亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲 乙
乙 丙
丙 丁
丁
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
-
工业上常用亚硝酸钠(NaNO2)作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备NaNO2并探究NO、NO2的某一化学性质(A中加热装置已略去)。

已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
请回答下列问题:
(1)装置A三颈烧瓶中发生反应的化学方程式为__________________。
(2)用上图中的装置制备NaNO2,其连接顺序为:a→_____________→h(按气流方向,用小写字母表示),此时活塞K1、K2如何操作_______________________。
(3)E装置发生反应的离子方程式是________________________。
(4)通过查阅资料,NO2或NO可能与溶液中Fe2+发生反应。某同学选择上述装置并按A→C→E顺序连接,E中装入FeSO4溶液,进行如下实验探究。

步骤②操作的目的是__________________;步骤③C瓶中发生的化学方程式为________________;
通过实验可以得出:___________(填“NO2、NO中的一种或两种”)和溶液中Fe2+发生反应使溶液呈深棕色。
-
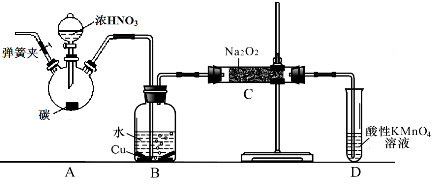
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1) 。
(2)D装置的作用是 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是 。
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是
A .测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式 。
-
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)

查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1)________________________________________________________________________________________________________ 。
(2)D装置的作用是________________________________________________________________________________________________________ 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________________________________________。
A亚硝酸盐是还原剂
B维生素C是还原剂
C维生素C将Fe3+还原Fe2+
D亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是
A 测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 。
-
(15分)亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
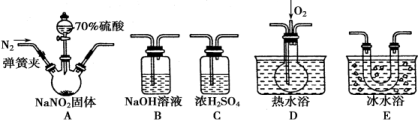
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是_________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是______________。
②装置E的作用是______________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为_____________。如果没有装置C,对实验结论造成的影响是_______________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是_________________。
-
亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=2NO2—+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
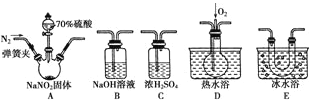
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、______、______。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________ 。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________________________。
②装置E的作用是________________________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为_______________________。
如果没有装置C,对实验结论造成的影响是__________________________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是________________________。
-
亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
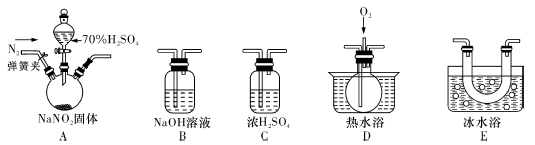
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、________、________、________。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是________。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是。
②装置E的作用是________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________。如果没有装置C,对实验结论造成的影响是________。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是________。
-
工业上常用亚硝酸钠 作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备
作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备 并探究NO、
并探究NO、 的某一化学性质
的某一化学性质 中加热装置已略去
中加热装置已略去 。请回答下列问题:
。请回答下列问题:
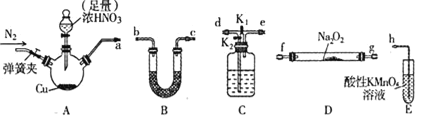
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
(1)装置A三颈烧瓶中发生反应的化学方程式为____________。
(2)用上图中的装置制备 ,其连接顺序为:
,其连接顺序为: ___
___ ____
____ ___
___ ___
___ ___
___ ___
___ 按气流方向,用小写字母表示
按气流方向,用小写字母表示 ,此时活塞
,此时活塞 、
、 如何操作____________。
如何操作____________。
(3) 装置发生反应的离子方程式是________________。
装置发生反应的离子方程式是________________。
(4)通过查阅资料, 或NO可能与溶液中
或NO可能与溶液中 发生反应。某同学选择上述装置并按
发生反应。某同学选择上述装置并按 顺序连接,E中装入
顺序连接,E中装入 溶液,进行如下实验探究。
溶液,进行如下实验探究。
| 步骤 | 操作及现象 |
| ① | 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色。 |
| ② | 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间 |
| ③ | 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同 |
步骤②操作的目的是___________;步骤③C瓶中发生的化学方程式为_________________;通过实验可以得出:___________ 填“
填“ 、NO中的一种或两种”
、NO中的一种或两种” 和溶液中
和溶液中 发生反应使溶液呈深棕色。
发生反应使溶液呈深棕色。


 乙
乙 丙
丙 丁
丁







