-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-  H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将_______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| 时间/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2___T1。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.相同时间内,断开H-H键的数目和生成N-H键的数目相同
D.容器内气体浓度c(N2):c(H2):c (NH3)=1:3:2
②P1_____P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:C点______B点_______D点。
③C点 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
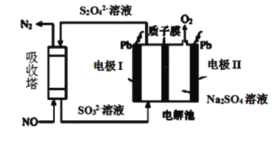
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
-
(16分)(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g) △H=―92.4 kJ·mol-1。
2NH3(g) △H=―92.4 kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q 184.8 kJ(填“>”、“<”或“=”)。
②已知:

1mol N—H键断裂吸收的能量为 kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,该温度下反应的平衡常数K = 。欲增大氮气的平衡转化率,可采取的措施有 (写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
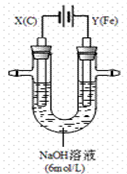
① 电解过程中,X极区溶液的pH (填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-== FeO42-+4H2O和 。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn == Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为 。
-
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:
N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
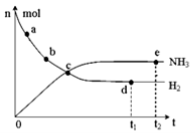
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止
-
运用化学反应原理研究碳、氮等单质和化合物的反应有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O (g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图如下:
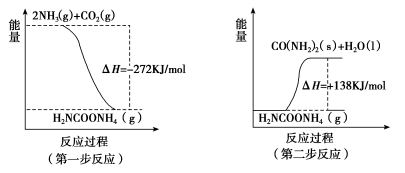
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为  。
。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为_________________。
-
(14分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
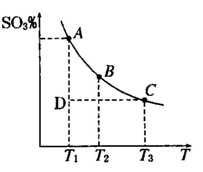
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H 0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;温度为T1时,反应进行到状态D时,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)
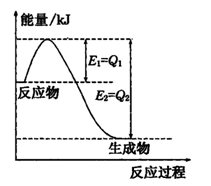
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
①如图是一定的温度和压强下N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,图中E1、E2分别表示的意义是____________、____________
②请写出工业合成氨的热化学方程式: (△H的数值用含字母Q1、Q2的代数式表示)
-
氨气是一种重要的化工产品。
(1)工业中用氯气和氢气在一定条件下合成氨气,有关方程式如下: 3H2 (g)+N2(g)⇌2NH3 (g) + 92.4 kJ
①对于该反应:要使反应物尽可能快的转化为氨气,可采用的反应条件是__________,要使反应物尽可能多的转化为氨气,可采用的反应条件是__________:(均选填字母)
A.较高温度B.较低温度C.较高压强 D.较低压强 E.使用合适的催化剂
工业上对合成氨适宜反应条件选择,是综合考虑了化学反应速率、化学平衡和设备材料等的影响。
②该反应达到平衡后,只改变其中一个因素,以下分析中不正确的是_______:(选填字母)
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小生成物浓度,对逆反应的反应速率影响更大
③某化工厂为了综合利用生产过程中副产品CaSO4,和相邻的合成氨厂联合设计了制备(NH4)2SO4的工艺流程(如图),该流程中:
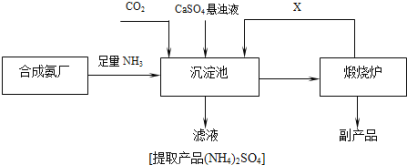
向沉淀池中通入足量的氨气的目的是______________________________,可以循环使用的X是_______________。(填化学式)
(2)实验室中可以用铵盐与强碱共热得到氨气。有关的离子方程式为_____________________。
①0.01 mol/L硝酸铵溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气_____L(标准状态)。
②若有硝酸铵和硫酸铵的混合溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气0.025mol;在反应后的溶液中加入足量的氯化钡溶液,产生0.01 mol 白色沉淀,则原混合液中,硝酸铵的浓度为_______mol/L。
③现有硝酸铵、氯化铵和硫酸铵的混合溶液V L,将混合溶液分成两等分:一份溶液与足量的氢氧化钠溶液共热,共产生氨气A mol;另一份溶液中慢慢滴入C mol/L的氯化钡溶液B L,溶液中SO42-恰好全部沉淀;将沉淀过滤后,在滤液中继续滴入硝酸银溶液至过量,又产生D mol沉淀。则原混合溶液中,氯化铵的浓度为________mol/L,硝酸铵的浓度为_______mol/L。(用含有字母的代数式表示)
-
对于工业合成氨反应: N2 + 3H2  2NH3,下列说法错误的是
2NH3,下列说法错误的是
A、使用合适的催化剂可以加大反应速率
B、升高温度可以增大反应速率
C、增大N2浓度可以使H2转化率达到100℅
D、增大N2浓度可以增大反应速率
-
合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g) + 3H2(g) 2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
A.N2、H2完全转化为NH3
B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态
D.N2、H2、NH3的浓度不再改变
-
合成氨的反应为:3H2 + N2  2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
A、v(H2)=v(N2) = v(NH3) B、v(H2)=3 v(N2) C、v(N2)=2 v(NH3) D、2v(NH3)=3v(H2)
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
H1=+1175.7 kJ·mol-1
H2=-771.1 kJ·mol-1
H3=+482.2 kJ·mol-1
H=_____________ kJ·mol-1。
4NO2(g)+O2(g) △H>0









