-
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe3+,提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A.NaOH B.CuO C.NH3•H2O D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)(已知lg5=0.7)
高二化学填空题困难题查看答案及解析
-
(每空2分,共10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_____
A、KMnO4 B、 H2O2 C、 Cl2 水 D、 HNO3
然后再继续加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+
而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)向25 mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,得到曲线如下图所示
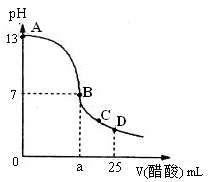
①、写出氢氧化钠溶液与醋酸溶液反应的离子方程式
②、该氢氧化钠溶液的物质的量浓度为
③、在B点,a________12.5 mL(填“大于”、“小于”或“等于”)
高二化学填空题简单题查看答案及解析
-
(8分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_________ 。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
高二化学填空题简单题查看答案及解析
-
在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+ 氧化为Fe3+ ,下列物质可采用的是( )
A.KMnO4 B.HNO3 C.Cl2 水 D. H2O2
高二化学选择题中等难度题查看答案及解析
-
(10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
高二化学填空题简单题查看答案及解析
-
(10分)
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=3.8,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损
失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=3.8是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可
以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,
Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1
时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的
pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填
“可行”或“不可行”)。
高二化学填空题简单题查看答案及解析
-
(10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4B. H2O2C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
高二化学填空题中等难度题查看答案及解析
-
(1)粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好选用的是___。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的___。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,调整溶液至pH=___Cu2+恰好沉淀完全。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=1.0×10-19。
高二化学填空题简单题查看答案及解析
-
(1)①在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液至pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,若溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为 ,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为 ,通过计算确定上述方案 (填“可行”或“不可行”)。
高二化学填空题困难题查看答案及解析
-
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)(已知lg2=0.3)
(3)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①滴定到达终点的现象是______________________________________。
②用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次
第二次
第三次
第四次
体积(mL)
17.10
18.10
17.00
16.90
则试样中过氧化氢的浓度为___________mol·L-1。
③若滴定前尖嘴中有气泡,滴定后消失,则测定结果______(填“偏低”、“偏高”或“不变”)。
高二化学综合题困难题查看答案及解析