-
Ⅰ、亚硝酸钠在漂白、电镀等方面应用广泛。现在木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。
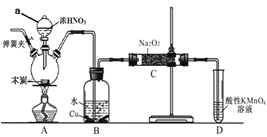
已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称__________________;
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________;
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式_________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________________ ;
(4)D装置中发生反应的离子方程式为__________________。
Ⅱ、焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
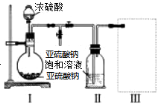
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为___________________;
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_______________;
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为____________(填序号);
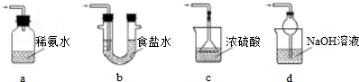
实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
在上述实验过程中,若有部分HI被空气氧化,则测定结果__________(填“偏高”“偏低”或“不变”)。
-
(10分)亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。
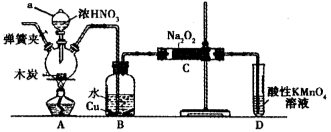
已知:
①3NaNO2+3HCl 3NaCl+HNO3+2NO↑+H2O
3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或 都能与
都能与 反应生成
反应生成 和Mn2+;
和Mn2+;
完成下列填空:
(1)写出a仪器的名称________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为_________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________;当该反应中转移0.1mol e-时,理论上吸收标准状况下NO的体积为___________L。
(4)D装置中发生反应的离子方程式为_____________________。
(5)将11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭_____________g。
-
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示。
已知:室温下,①2NO+Na2O2=2NaNO2
②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5 NO2— + 2MnO4—+ 6H+= 5NO3—+ 2Mn2++ 3H2O
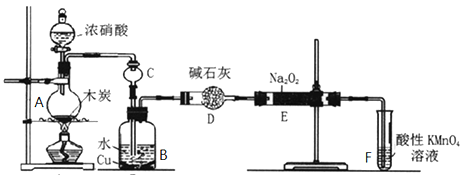
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物__________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 mL,取出25 mL溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)____________________________。
-
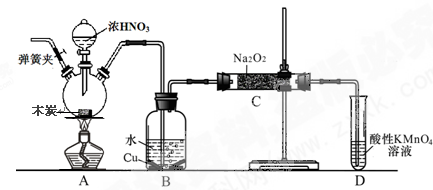
(8分)亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
-
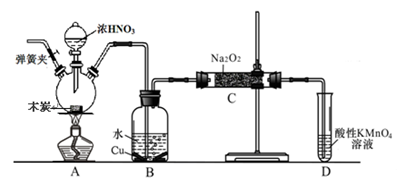
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
-
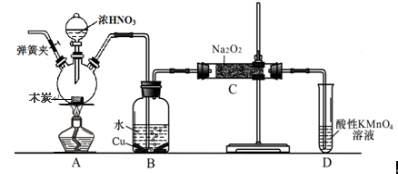
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
-
(12分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
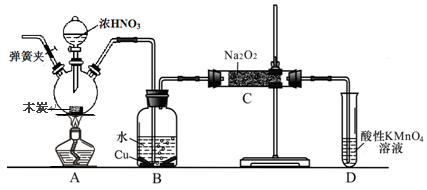
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
-
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
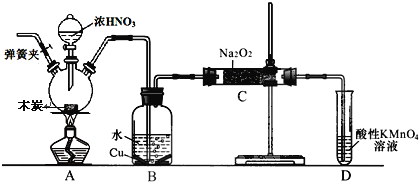
已知:室温下,①2NO+Na2O2→2NaNO2
②酸性条件下,NO 或 都能与
都能与 反应生成
反应生成 和 Mn2+
和 Mn2+
③B 中的 Cu 足量
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式__________。
(2)检查完该装置的气密性,装入药品后,必须进行的一步操作是______________;
(3)D 装置的作用是 ________。
(4)经检验 C 产物中除亚硝酸钠外还含有副产物碳酸钠和_______,为避免产生这些副产物应在 B、C装置间增加装置 E,E 中盛放的药品名称________。
(5)将 7.8g 过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭_______________g。
-
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2→2NaNO2 ②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;
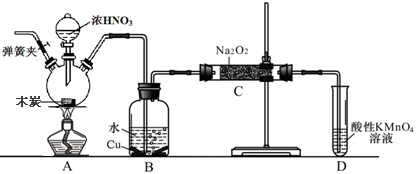
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式________。
(2)B中观察到的主要现象是________,D装置的作用是________。
(3)检验C中产物有亚硝酸钠的方法是________。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和________,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称________。
(5)写出检验C产物中是否含碳酸钠的方法________。
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g。
-
(14分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。
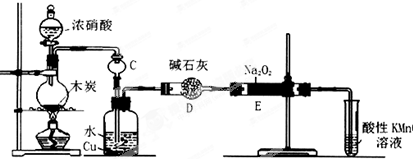
已知:室温下,① 2NO+Na2O2=2NaNO2
② 酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,
5 NO2— + 2MnO4—+ 6H+= 5NO3—+ 2Mn2++ 3H2O
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有______________,_______________。
(3)装置C的作用:________________,装置F的作用:_______________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液
C.淀粉 D.白糖
E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 ml,取出25 ml溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)












