-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO  CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)  2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g) 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是________(填A或B)阴极反应式为________________________________________。
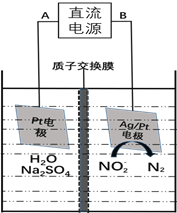
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差 为_________g。
为_________g。
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO  CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)  2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g) 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是________(填A或B)阴极反应式为________________________________________。
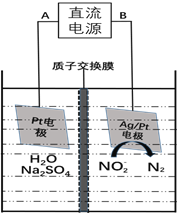
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差 为_________g。
为_________g。
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO  CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)  2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g) 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是________(填A或B)阴极反应式为________________________________________。
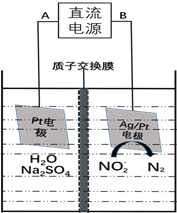
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差 为_________g。
为_________g。
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO  CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)  2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g) 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是________(填A或B)阴极反应式为________________________________________。
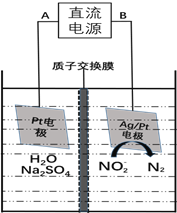
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差 为_________g。
为_________g。
-
研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g) △H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g) △H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g) △H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g) ,经10min反应达到平衡,容器的压强变为原来的 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____ ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。
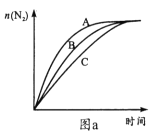
(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
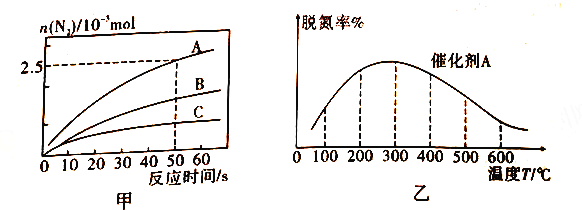
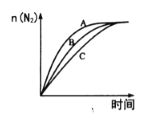
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
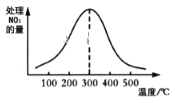
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。
(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
-
研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g) 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
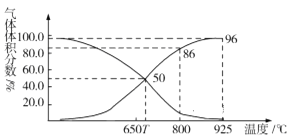
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
-
研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g) 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
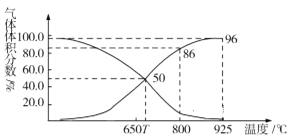
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
-
NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
② N2(g)+
N2(g)+  O2(g)
O2(g) NO(g) △H= +89.75kJ/mol,K2
NO(g) △H= +89.75kJ/mol,K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2) 污染性气体NO2与CO 在一定条件下的反应为2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的 ,则反应开始到平衡时CO 的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为a mol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO 的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为a mol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3) 研究发现: NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR) 技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知: N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s) +O2(g) =2CO(g) △H2=-221kJ/mol K2 (同上)
C(s) +O2(g) =CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g) 与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:
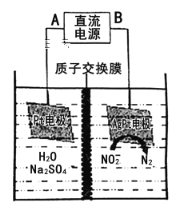
阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: 汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知: N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s) +O2(g) =2CO(g) △H2=-221kJ/mol K2 (同上)
C(s) +O2(g) =CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g) 与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L 密闭容器中充入0.lmol NO和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若此温度下,某时刻测得NO2、CO、CO2、 N2的浓度分别为1mol/L、0.4mol/L、0.lmol/L、a mol/L,要使反应向逆反应方向进行,a 的取值范围_________。
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如下图:
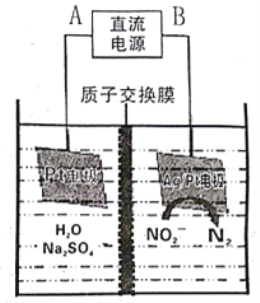
①电源的正极是___ (填A或B),阴极反应式为___________。
②若电解过程中转移了3mol 电子,则膜两侧电解液的质量变化差 为______g。
为______g。
。












