-
恒温下,将a mol N2与b molH2的混合气体通入到一个固定容积的密闭容器中,发生如下反应:N2 (g)+3H2(g)
 2NH3(g),请计算并填空:
2NH3(g),请计算并填空:
(1)若反应到时刻t时,n (N2)=13mol,n (NH3)=6mol,则a=______mol;
(2)上述混合气体反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的体积分数为25%,则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=______(写出最简整数比,下同);原混合气体中,a:b=______;达到平衡时,N2和H2的转化率α(N2):α(H2)=______;平衡混合气体中,n(N2):n(H2):n(NH3)=______.
-
恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a的值为______.
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%.则平衡时NH3的物质的量为______.
(3)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
(4)原混合气体中,a:b=______.
(5)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______.
(6)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=______.
-
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
-
恒温下,将2molSO2和1mo O2的混合气体通入一个容积固定的5L密闭容器中,发生如下反应:2SO2(g)+O2 (g)  2SO3 (g)
2SO3 (g)
(1)若2分钟后,测得O2的浓度为0.1mol/L,则2分钟内O2的平均反应速率为____________。
(2)5分钟后反应达平衡,混合气体的物质的量为2.4mol,则平衡时SO3的物质的量为_______________ 。
(3)达平衡时,SO2的转化率为____________ ,平衡时容器内的压强与起始时的压强之比为___________ 。
(4)若平衡后,向该容器中充入一定量的氩气,化学平衡将_____________ 。(正向移动、逆向移动、不移动);若平衡后,向该容器中再充入2molSO2和1molO2,当反应再次达平衡时,SO2的转化率将____________ (增大、减小、不变)。
-
一定条件下,在一固定容积的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
一定条件下,在一固定容积密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
-
在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2+3H2
 2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
(1)通过计算说明起始充入N2和H2的物质的量分别为:x=______,y=______.平衡后NH3的体积分数______
(2)写出该反应的热化学方程式______.
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该______18.4kJ(填大于、小于或等于).
(4)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同.
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为______kJ.
②若维持反应向正反应方向进行,则起始时c的取值范围为______.
-
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
|  时间(h) 时间(h)
物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
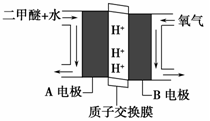
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。
-
在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A.2 c1>c3 B.a + b=92.4 C.2P1<P3 D.α1 +α3=1
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是( )
A.平衡常数约为0.3
B.B的转化率为60%
C.A的平均反应速率为0.3 mol/(L·min)
D.若混合气体的密度不变则表明该反应达到平衡状态
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是
A.平衡常数约为0.3
B.B的转化率为60%
C.A的平均反应速率为0.3 mol/(L·min)
D.若混合气体的密度不变则表明该反应达到平衡状态
