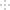-
氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+1/2O2(g) H2O(g) △H1=-198kJ/mol
H2O(g) △H1=-198kJ/mol
②CO(g)+1/2O2(g) CO2(g) △H2=-283kJ/mol
CO2(g) △H2=-283kJ/mol
③CH4(g)+2O2(g) CO2(g)+2H2O(g) △H3=-846.3kJ/mol
CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g) CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2(填“<”“=”或“>”)。
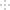
②在2L恒容密闭容器中充入2 mol CO和4 mol H2,在一定条件下经过10 min达到平衡状态c点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=_______________,平衡常数Ka、Kb、Kc 的大小关系:___________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由大到小的顺序为___________。
-
氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+ O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g) CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2 (填“<”、“=”、“>”)。
②在2L恒容密闭容器中充入2molCO和4molH2,在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=________,平衡常数Ka、Kb、Kc的大小关系:____________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为___________。
-
天然气( 主要成分为甲烷)是一种高效的清洁能源,也是一种重要的化工原料,利用天然气制备甲醇、乙醇、二甲醚(CH3OCH3)、乙烯(C2H4)等物质的主要反应有:
①CH4(g)+H2O(g)=CO(g)+ 3H2(g) △H1= + 206.2 kJ/ mol
②CO(g)+2H2(g)=CH3OH(g) △H2=- 90.1kJ/ mol
③2CH3OH(g) = CH3OCH3(g) + H2O(g) △H3=- 24.5kJ/ mol
④2CH3OH(g)  C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
⑤CH3OCH3(g)== C2H5OH(g) △H5=- 50.7 kJ /mol
请回答下列问题:
(1)反应2CH4(g)+H2O(g)= C2H5OH(g)+2H2(g)的△H =______kJ/mol;根据化学原理,可 以同时加快该反应的速率和提高甲烷转化率的措施有_______________________。
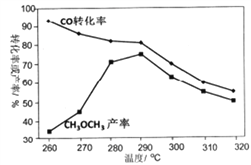
(2)CO与H2在一定条件下,同时发生②和③的反应,产生二甲醚的结果如上图所示。260℃时,CO转化率虽然很高,而二甲醚的产率却很低,可能的原因是 ( 答出一条即可) _______;CO 与H2 合成二甲醚的最佳的温度是_____________。
(3) 对于气体参与的反应如反应④[2CH3OH(g)  C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=____;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=_____________。
C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=____;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=_____________。
(4) 反应①~⑤中有多种物质可以做燃料电池的燃料,其中H2是单位质量燃料释放电能最多的物质,若与下列物质构成电池,H2 与_______构成的电池比能量最大。
a.H2O2 b.Cl2 C.O2 d.NiOOH
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
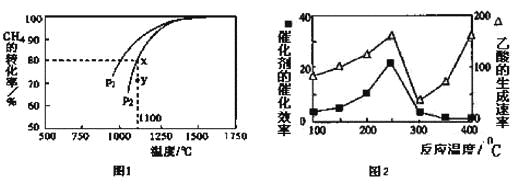
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式____________。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=__________。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=__________。(计算结果保留两位有效数字)
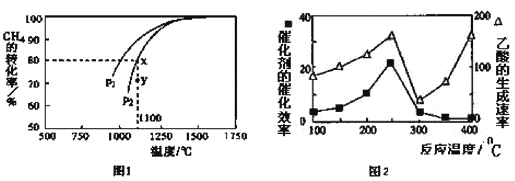
(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
-
氢气不仅是新能源,也是重要的化工原料。
(1)氢气可由甲烷制备:CH4 (g)+H2O(l) CO(g)+3H2 (g)ΔH=+250.1 kJ·mol-1,已知298 K时,CH4(g)、CO(g)的燃烧热分别为890 kJ·mol-1、283 kJ·mol-1。写出氢气燃烧热的热化学方程式___________。
CO(g)+3H2 (g)ΔH=+250.1 kJ·mol-1,已知298 K时,CH4(g)、CO(g)的燃烧热分别为890 kJ·mol-1、283 kJ·mol-1。写出氢气燃烧热的热化学方程式___________。
(2)利用反应CO(g)+2H2(g) CH3OH(g) ΔH合成清洁能源CH3OH,CO的平衡转化率与温度的关系如图所示:
CH3OH(g) ΔH合成清洁能源CH3OH,CO的平衡转化率与温度的关系如图所示:
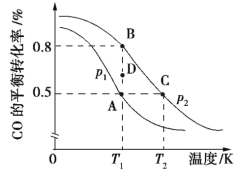
①该可逆反应的正反应ΔH______0; A、B、C三点平衡常数KA、KB、KC的大小关系是_____; 压强p1___p2(填“>”“<”或“=”); 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系: v正___v逆(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_____________________ (填序号)。
a.CO物质的量保持不变
b.单位时间内消耗CO的浓度和生成甲醇的浓度相等
c.混合气体的压强不再变化
d.混合气体的密度不再变化
③在2 L恒容密闭容器中充入2 mol CO和4 mol H2,在p2 (和T2条件下经10 min达到平衡状态C点,在该条件下,v(CH3OH)=______________________;平衡常数K为_________________________________
-
氢气是一种清洁能源,又是合成氨工业的重要原料。
(1)已知:CH4(g)+H2O==CO+3H2(g) △H=206.2 kJ·mol-1。
CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=247.4 kJ·mol-1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为___________________。
(2)工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测 得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(NH3)=__________mol·L-1·min-1,该温度下该反应的平衡常数K=________。 欲增大氮气的平衡转化率,可采取的措施有_____________、____________等(共写两条措施即可,每空一条)。
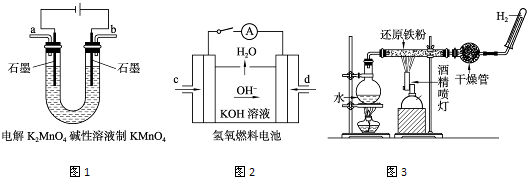
(3)下图所示装置工作时均与H2有关。
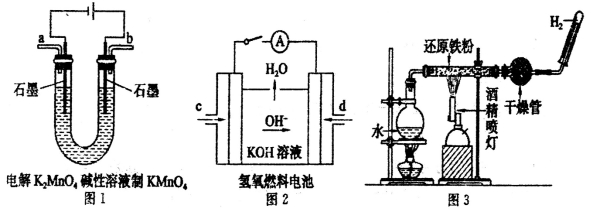
图l所示装置中阳极的电极反应式为______________。
②图2所示装置中,通入H2的管口是_____________(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后.将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液。溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论_____________(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明)______________________。
-
氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为______.
(2)工业合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.
某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内的平均反应速率v(H2)=______mol/,该温度下该反应的平衡常数K=______.
欲增大氮气的平衡转化率,可采取的措施有______(写一种措施即可).
(3)图所示装置工作时均与H2有关.
①图1所示装置中阳极的电极反应式为______.
②图2所示装置中,通入H2的管口是______(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论______(填“严密”或“不严密”),你的理由是______(用离子方程式表示).
-
氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为______.
(2)工业合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.
某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内的平均反应速率v(H2)=______mol/,该温度下该反应的平衡常数K=______.
欲增大氮气的平衡转化率,可采取的措施有______(写一种措施即可).
(3)图所示装置工作时均与H2有关.
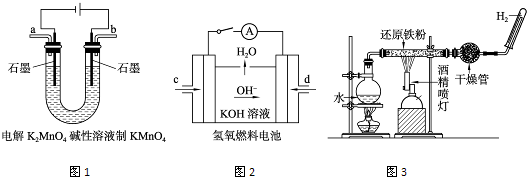
①图1所示装置中阳极的电极反应式为______.
②图2所示装置中,通入H2的管口是______(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论______(填“严密”或“不严密”),你的理由是______(用离子方程式表示).
-
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
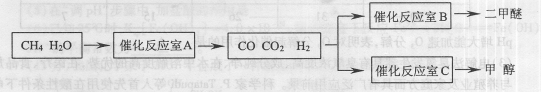
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为________.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为________。
×100%,试求反应(Ⅳ)的原子利用率为________。
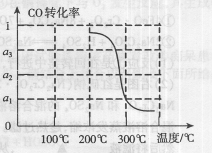
②反应(Ⅳ)的△S ________0(填“>”、“=”或“<”)。
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H________0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= ________(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
CO(g)+3H2(g)
O2(g)=H2O(g) △H1=-198kJ/mol
CO(g)+3H2(g) △H4=________。
CH3OH(g) △H=-116kJ/mo1