-
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
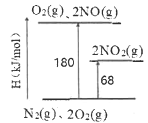
I.(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 moI NO2的能量变化)。1 moI NO氧化为NO2的焓变△H=___________kJ/mol。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___________(填“a”或“b”);反应2NO(g)+O2(g) 2NO2(g)的K=___________。
2NO2(g)的K=___________。
(3)已知反应2NO(g)+O2(g) 2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
第一步:NO+NO=N2O2 快速平衡
第二步:N2O2+O2 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),ν(逆)=k-1c(N2O2)。下列叙述正确的是___________(填字母)。
A.第一步反应的平衡常数K=
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
II.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。工业上可利用反应2C12(g)+NH3(g) NHCl2(l)+HCl(g)制备二氯胺。
NHCl2(l)+HCl(g)制备二氯胺。
(1)二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式______________________。
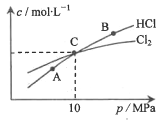
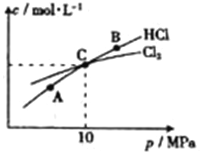
(2)在恒温条件下,将2 mol Cl2和1 moI NH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HC1的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___________点(填“A”“B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=___________(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
-
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为436kJ·mol-1,N—H键的健能为391kJ·mol-1,N N键的键能是945.6 kJ·mol-1,则反应NH3(g)
N键的键能是945.6 kJ·mol-1,则反应NH3(g)
 N2(g)+
N2(g)+ H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g)  2NH3(g)的平衡常数K1=___________(用K表示)
2NH3(g)的平衡常数K1=___________(用K表示)
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。
(1)工业上可利用反应2Cl2(g)+NH3(g) NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式_______________________。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点( 填“A” “B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=_____________(Kp是平衡分压代替平衡浓度计算,分压= 总压×物质的量分数。)
(2)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g) NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
| t /min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按 =
= 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
-
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
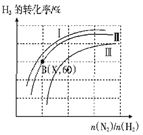
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是_________________;测得B(X,60)点时N2的转化率为50%,则X=________。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________。
-
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+l025kJ•mol-1
4NH3(g)+5O2(g) △H=+l025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3 从高到低的顺序是_________________;测得B(X,60)点时N2的转化率为50%,则X=________。
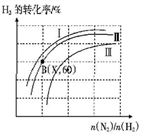
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________。
-
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为a kJ·mol-1,N—H键的键能为bkJ·mol-1,N N键的键能是ckJ·mol-1,则反应NH3(g)
N键的键能是ckJ·mol-1,则反应NH3(g)
 N2(g)+
N2(g)+ H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g) 2NH3(g)的平衡常数K1=____(用K表示)。
2NH3(g)的平衡常数K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g) NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| 甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),该反应的ΔH___0(填“>”或“<”)。
②该反应自发进行的条件是____(填高温、低温、任何温度)。
③对该反应,下列说法正确的是___(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D.反应达到平衡后,其他条件不变,在原容器中按 =1继续充入一定量反应物,达新平衡后Cl2的转化率增大
=1继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g) NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式____。
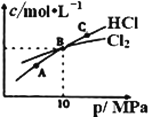
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=____。
-
氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。已知H—H键的键能为a kJ·mol-1,N—H键的键能为b kJ·mol-1,N≡N键的键能是c kJ·mol-1,则反应NH3(g)⇌ N2(g)+
N2(g)+  H2(g)的ΔH=_______ kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)⇌2NH3(g)的平衡常数K1=_______(用K表示)。
H2(g)的ΔH=_______ kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)⇌2NH3(g)的平衡常数K1=_______(用K表示)。
-
I.氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。请回答下列问题:
(1)亚硝酰氯(结构式为 )是有机合成中的重要试剂,它可由
)是有机合成中的重要试剂,它可由 和
和 在常温常压条件下反应制得,反应方程式为:
在常温常压条件下反应制得,反应方程式为: 。已知几种化学键的键能数据如表所示:
。已知几种化学键的键能数据如表所示:
则
 ________
________ 。
。
(2)在一个恒容密闭容器中充入 和
和 发生(1)中的反应,在温度分别为
发生(1)中的反应,在温度分别为 ℃、
℃、 ℃时测得
℃时测得 的物质的量(单位:mol)与时间的关系如下表所示:
的物质的量(单位:mol)与时间的关系如下表所示:
| t/min 温度 | 0 | 5 | 8 | 13 |
| 
| 2 | 1.5 | 1.3 | 1.0 |
| 
| 2 | 1.15 | 1.0 | 1.0 |
① ________
________ (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②温度为 时,起始时容器内的压强为
时,起始时容器内的压强为 ,则该反应的平衡常数
,则该反应的平衡常数 ________(用平衡分压代替平衡浓度计算,分压
________(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)(化为最简式)。
物质的量分数)(化为最简式)。
(3)近年来,地下水中的氮污染已成为世界性的环境问题。在金属 、
、 和依(
和依( )的催化作用下,
)的催化作用下, 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮( ),其工作原理如图所示。
),其工作原理如图所示。
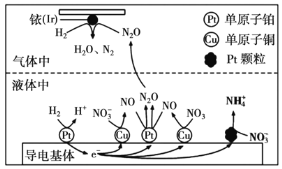
① 表面发生反应的化学方程式为:________。
表面发生反应的化学方程式为:________。
②若导电基体上的 颗粒增多,造成的后果是________。
颗粒增多,造成的后果是________。
Ⅱ.利用电化学原理,将 、
、 和熔融
和熔融 制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
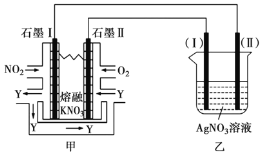
(4)①甲池工作时, 转变成绿色硝化剂
转变成绿色硝化剂 ,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
②若用10A的电流电解50min后,乙中阴极得到 ,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为
,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为 )
)
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式________,该反应的熵变⊿S________0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
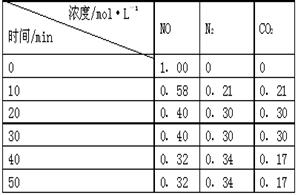
①10min~20min以V(CO2) 表示的反应速率为 ________。
②该反应的平衡常数的表达式为:K=________,根据表中数据,计算T1℃时该反应的平衡常数为________ ________(保留两位小数)。
③下列各项能作为判断该反应达到平衡的是________(填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”) 。
-
含氮化合物在生产、生命活动中有重要的作用。回答下列问题:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,写出在298K时,氨气燃烧生成N2的热化学方程式___________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g) MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
| P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
| α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=___________。
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=___________(用含有k正、k逆的式子表示)。
(3)构成肌红蛋白的甘氨酸(NH2CH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下:





在甘氨酸溶液中加入酸或碱,三种离子的百分含量与 的关系如图所示:
的关系如图所示:
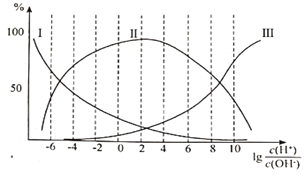
①纯甘氨酸溶液呈___________性;当溶液呈中性时三种离子的浓度由大到小的顺序为___________。
②向 =8的溶液中加入过量HCl时,反应的离子方程式为___________。
=8的溶液中加入过量HCl时,反应的离子方程式为___________。
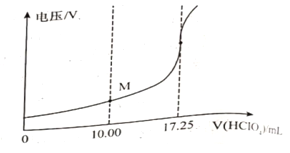
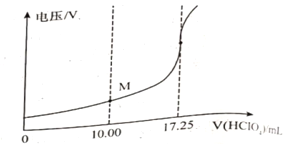
③用电位滴定法可测定某甘氨酸样品的纯度.
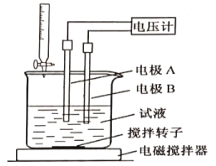
称取样品150mg,在一定条件下,用0.1000mol/L的高氯酸溶液滴定(与甘氨酸1︰1发生反应),测得电压变化与滴入HClO4溶液的体积关系如下图。做空白对照实验,消耗HClO4溶液的体积为0.25mL,该样品的纯度为___________%(计算结果保留一位小数)
-
含氮化合物在生产、生命活动中有重要的作用。回答下列问题:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,写出在298K时,氨气燃烧生成N2的热化学方程式___________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g) MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
| P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
| α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=___________。
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=___________(用含有k正、k逆的式子表示)。
(3)构成肌红蛋白的甘氨酸(NH2CH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下:





在甘氨酸溶液中加入酸或碱,三种离子的百分含量与 的关系如图所示:
的关系如图所示:
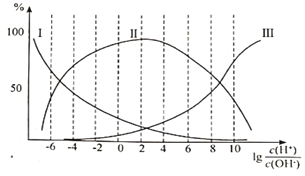
①纯甘氨酸溶液呈___________性;当溶液呈中性时三种离子的浓度由大到小的顺序为___________。
②向 =8的溶液中加入过量HCl时,反应的离子方程式为___________。
=8的溶液中加入过量HCl时,反应的离子方程式为___________。
③用电位滴定法可测定某甘氨酸样品的纯度.
称取样品150mg,在一定条件下,用0.1000mol/L的高氯酸溶液滴定(与甘氨酸1︰1发生反应),测得电压变化与滴入HClO4溶液的体积关系如下图。做空白对照实验,消耗HClO4溶液的体积为0.25mL,该样品的纯度为___________%(计算结果保留一位小数)
N键的键能是945.6 kJ·mol-1,则反应NH3(g)
N2(g)+
H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
2NH3(g)的平衡常数K1=___________(用K表示)
NHCl2 (l)+2HCl(g)制备二氯胺。

NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
=
继续充入一定量反应物,达新平衡后Cl2的转化率增大













