-
将一定量的Cl2通入体积为40mL、浓度为7.5 mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO物质的量0.03mol,下列说法不正确的是( )
A.该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O
B.该反应中,氧化剂与还原剂物质的量之比为5:3
C.上述苛性钾溶液中含有0.3mol的KOH
D.反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性
高一化学选择题极难题查看答案及解析
-
将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子:Cl-、ClO-、ClO3-。下列说法不正确的是
A. 反应过程中氯气消耗0.15mol
B. 当溶液中n(KClO):n(KClO3)=2:1时,该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3-+5H2O
C. 反应生成的ClO-和ClO3-在一定条件下均有氧化性
D. 若反应中转移的电子为n mol,则0.15﹤n﹤0.3
高一化学单选题中等难度题查看答案及解析
-
将一定量的Cl2通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,请按要求完成下列问题
(1)该反应的离子方程式为___________________________________________。
(2)该反应中,氧化剂与还原剂物质的量之比为____________________。
(3)上述反应中,通入Cl2的物质的量为________mol,氢氧化钾溶液的物质的量浓度为________mol/L。
高一化学综合题中等难度题查看答案及解析
-
标准状况下H2和Cl2组成的混合气体2.24L,经点燃充分反应后,缓缓通入100mL 1.2mol/LNaOH溶液中恰好完全反应,测得最终溶液中NaClO的浓度为0.2mol/L(假设溶液体积不变),则原混合气体中Cl2的体积分数(物质的量百分含量)为
A.55% B.60% C.65% D.70%
高一化学选择题中等难度题查看答案及解析
-
将一定量的氯气(分子式为Cl2)通入30 mL浓度为10 mol/L的氢氧化钠浓溶液中,加热少许时间后恰好完全反应,溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. Cl2在反应中既作氧化剂又作还原剂
B. NaClO 和NaClO3是还原产物
C. 生成物 n(NaCl) :n(NaClO) :n(NaClO3) 一定为6:1:1
D. 与NaOH反应的氯气一定为3.36 L
高一化学单选题困难题查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示。下列说法错误的是( )
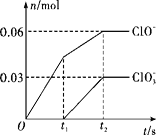
A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.42NA
C. 原苛性钾溶液中KOH的物质的量为0.3 mol
D. 生成物中Cl-的物质的量为0.21 mol
高一化学单选题中等难度题查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有3种含氯元素的离子,其中ClO-和ClO
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
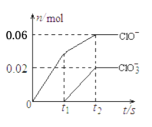
A.苛性钾中KOH的物质的量为0.24mol
B.反应中转移电子的物质的量是0.21mol
C.有2.688L氯气参与反应
D.酸性条件下ClO-和ClO
可生成Cl2
高一化学单选题困难题查看答案及解析
-
将一定量的Cl2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。 下列说法正确的是( )
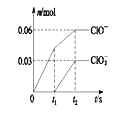
A.苛性钾溶液中KOH的物质的量为0.18mol
B.反应中转移电子的物质的量是0.09 mol
C.在酸性条件下ClO- 和ClO3-能反应得到氯气
D.ClO3-的生成可能是由于温度升高引起的
高一化学单选题中等难度题查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
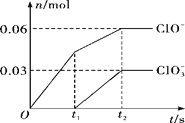
A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.21 NA
C. 原苛性钾溶液中KOH的物质的量无法确定
D. 生成物中Cl- 的物质的量为 0.21 mol
高一化学单选题困难题查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
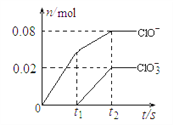
A. 苛性钾溶液中KOH的质量是5.6 g
B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2
D. 一定有3.136 L氯气参与反应
高一化学单选题困难题查看答案及解析