-
含硫化合物在工业上应用广泛,硫化物是脱硫、染料行业重要的原村料。
(1)酸工业烟道气中的SO2、CO.可用如图所示的综合循环吸收法脱除:
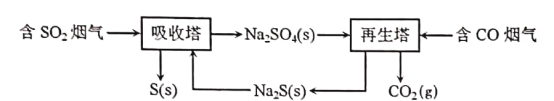
已知再生塔中每产生 I mol CO2(g),放出29.9的热量,则其热化学方程式为______。
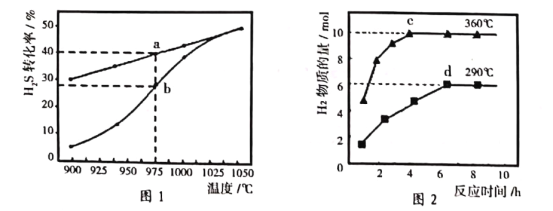
(2)H2S热分解反应为:2H2S(g) 2H2(g)+S2(g)。在恒容密闭容器中,H2S的起始浓度均为cmol・L—1,控制不同温度使之分解.相同时间后测的H2S转化率曲线如图1所示:其中a为平衡时转化率、b为未平衡时转化率分别与温度的关系曲线。
2H2(g)+S2(g)。在恒容密闭容器中,H2S的起始浓度均为cmol・L—1,控制不同温度使之分解.相同时间后测的H2S转化率曲线如图1所示:其中a为平衡时转化率、b为未平衡时转化率分别与温度的关系曲线。
①在975℃:t秒时反应达到平衡,则平衡前反应的平均速率v(S2)=_____(用含c、t的代数式表示)。
②请说明随温度的升高,曲线b向曲线a逼近的原因:______________。
(3)725℃时,H2S的电离平衡常数K=1.3×10-7、Ka2=7.0×10-15。用NaOH溶液吸收H2S气体得到pH=10的Na2S溶液,在此过程中水的电离程度将______(填“增大”、“减小”或”不变”);此时溶液中 =_____________________
=_____________________
(4)加热Na2S溶液可以生成Na2S2O3,NaOH和H2,温度升高时还可生成Na2SO4,图2是含3 mol Na2S的溶液在不同温度下反应,生成H2物质的量与反应时间的关系。分析图象,完全反应后生成Na2S2O3物质的量最多的是______(填”c”或”d“)点:不考虑离子的水解,则c点溶液中浓度最高的阴离子为______(写化学式),S2O32—的物质的量为_______。
-
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
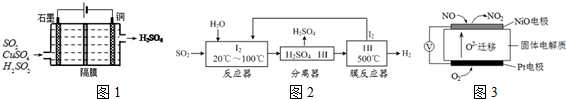
(1)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2﹣2n)H2O═2n CuSO4+(2﹣2n) H2SO4从环境保护的角度看,催化脱硫的意义为 ;每吸收2molSO2,被SO2还原的O2的质量为 g.
②利用如图1所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式 .
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图2:
①用离子方程式表示反应器中发生的反应是:
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
Ⅱ.汽车尾气是造成雾霾天气的重要原因之一.
已知氮的氧化物是汽车尾气的污染物,用如图3装置可监测其含量,电池中每转移0.4mole﹣,Pt 电极消耗 L氧气(标况下)该装置的负极反应式为 .
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
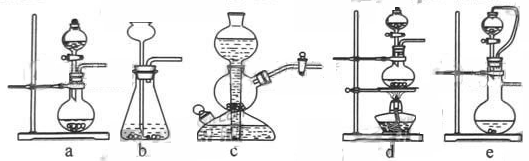
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是 ________ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 ________g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 ________ g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
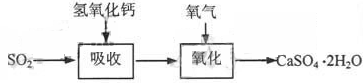
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
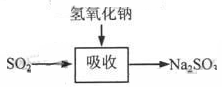
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 ________ 。和碱法相比,石灰-石膏法的优点是 ________ ,缺点是 ________ 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
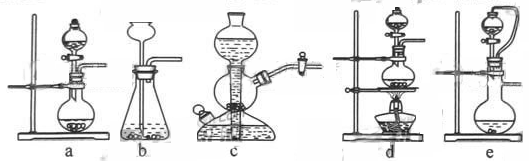
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是________________________________________________________________________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠________________________________________________ g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠________________________________________________________ g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
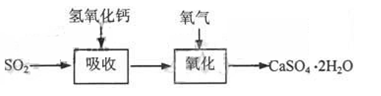
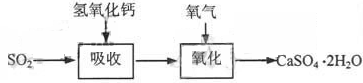
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
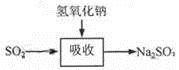
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是________________________________________________________________________________________________________________________________________ 。和碱法相比,石灰-石膏法的优点是________________________________________________________________________________________________________ ,缺点是________________________________________________________________________________________________________________________________ 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
-
硫的化合物在生产生活中有广泛应用。
(1)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:
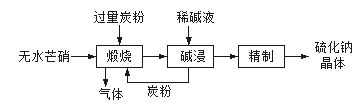
① 上述流程中采用稀碱液比用热水更好,理由是__________________。
② 取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)=______mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(2)工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3。KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用0.01000 mol·L−1 KIO3酸性标准溶液滴定至终点,消耗KIO3溶液31.25mL。
① 滴定终点观察到的现象为:_____________________。
② 成品中Na2SO3的质量分数是_________(请写出计算过程)。
-
含硫化物是自然界中最为重要的自然资源之一,在生产生活中应用非常广泛。
(1)燃煤烟气的脱硫(除SO2)技术和脱硝(除NOx)技术是环境科学研究的热点。以下是用硫和氮的氧化物之间的相互转化联合进行的脱硫和脱硝技术反应的热化学方程式。
NO2(g)+SO2(g)+H2O(l)=H2SO4(l) +NO(g) △H=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H=b kJ·mol-1
① 反应2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l) 的△H=_______KJ/mol-1。
② 将SO2通入硫酸铁溶液也能发生类似的反应。请写出该反应的离子方程式____________ 。
(2)MnSO4是重要的基础锰盐。工业上,生产MnSO4的方法有多种。
①一种较为环保的方法是:利用纤维素水解产物还原软锰矿的方法生产MnSO4,其反应方程式如下:(C6H10O5)n+nH2SO4→n(C6H11O5)HSO4
n(C6H11O5)HSO4 +nH2O →n C6H12O6+nH2SO4
C6H12O6 +12H2SO4+12MnO2→12MnSO4+6CO2↑+18H2O
从理论上讲,每生产1吨MnSO4需要的纤维素的质量为____吨。
②软锰矿中都含有一定量的砷的化合物,如果不除砷很难达到饲料级的生产标
准。工业上常用氧化剂来除去其中的砷。可以除去砷的氧化剂有:ClO-、KMnO4、(NH4)2S2O8、O3、H2O2等,但在实际生产中,选用的氧化剂是软锰矿,可能的原因是_________。
③在生产MnSO4的浸出渣中常会产生一些硫磺,可以利用四氯乙烯来回收硫磺,
回收硫磺过程中受外界影响较大的因素主要有:萃取温度、液固比等。下图1是上述3种因素对萃取硫磺质量影响的关系图。

请根据以上图表信息,选择最佳的萃取温度和液固比_____________。
(3)有人设想用电化学法将SO2转化为H2SO4的原理如图2所示。
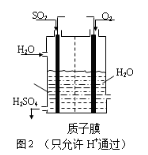
① 该电解质溶液中质子的流向是_____;(填“从正极流向负极”或“从负极流向正极”)
② 写出该电池负极反应的电极反应方程式:_________
-
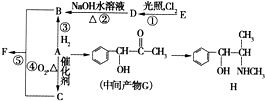
芳香化合物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A制得某药物H的转化关系如图所示(由A→G,G→H的反应条件和部分反应物已略去)。
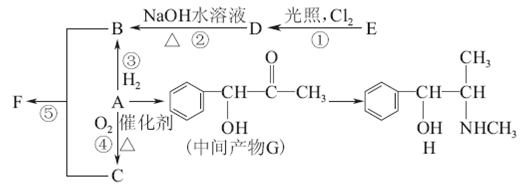
请回答下列问题:
(1)有机物A的相对分子质量为106,A中所含碳氢氧三种元素的质量比为42∶3∶8,A的结构简式为________,检验A中含氧官能团的方法是________。
(2)关于药物H的下列说法中正确的是________(填字母)。
a.H的分子式为C10H15NO
b.该物质核磁共振氢谱图中有8个峰
c.属于芳香烃
d.能发生加成、消去、氧化反应
(3)写出D→B的化学方程式________。
(4)反应 ①~⑤属于取代反应的是________(填序号)。
(5)B和C生成F的化学方程式为________。
(6)写出符合下列条件的G的同分异构体的结构简式________。
①既能发生消去反应,又能发生酯化反应
②苯环上的一氯取代物只有两种,分子结构中没有甲基
③能发生银镜反应
-
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以 [Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
I.电解处理法
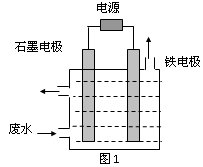
用图1所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。
(1)铁电极为___________(填“阴极”或“阳极”),阳极产生ClO-的电极反应为_______________。
II.UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O===A+NH3↑,则A是 (用符号表示)。
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应______________。
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为______(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原因_______________。

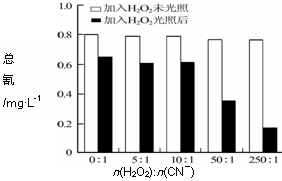
图2:不同pH对除氰效果的影响 图3:H2O2加入量对除氰效果的影响
(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度。由图可知:n(H2O2):n(CN-)=250:1时,剩余总氰为0.16 mg·L-1,除氰率达80%,计算0-30 min时间段反应速率v(CN-)=____________mg·L-1min-1(结果保留两位有效数字)。
-
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以 [Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
I.电解处理法
用图1所示装置处理含CN-废水时,控制溶液pH为9~10 ,并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。
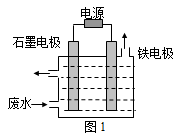
(1)铁电极为___________(填“阴极”或“阳极”),阳极产生ClO-的电极反应为_____________。
II.UV(紫外光线的简称)—H2O2氧化法。实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸, 易挥发。
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O===A+NH3↑,则A是 (用符号表示)。
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应___________________。
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为______(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原因________________。

(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度。由图可知:n(H2O2):n(CN-)=250:1时,剩余总氰为0.16 mg·L-1,除氰率达80%,计算0-30 min时间段反应速率v(CN-)= ____________mg·L-1min-1(结果保留两位有效数字)。
-
有机物A是重要的化工合成原料,在医药、染料和香料等行业有着广泛的应用.由A制得某药物H的转化关系如图所示(A→G、G→H的反应条件和部分反应物已略去).
请回答下列问题:
(1)已知有机物A的相对分子质量为106,且A中所含碳、氢、氧三种元素的质量之比为42:3:8,则A的结构简式为______,检验A中含氧官能团的方法是______.
(2)下列关于药物H的说法正确的是______(填序号).
A.H的分子式为C10H15NO
B.该物质的核磁共振氢谱图中有9组峰
C.H属于芳香烃
D.H能发生加成反应、消去反应、氧化反应
(3)写出D→B的化学方程式:______.
(4)反应①~⑤中属于取代反应的是______(填序号).
(5)B和C反应生成F的化学方程式为______

2H2(g)+S2(g)。在恒容密闭容器中,H2S的起始浓度均为cmol・L—1,控制不同温度使之分解.相同时间后测的H2S转化率曲线如图1所示:其中a为平衡时转化率、b为未平衡时转化率分别与温度的关系曲线。

=_____________________

















