-
工业合成氨反应:N2+3H2 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
(1)已知1 mol N2完全反应生成NH3可放出92kJ热量。如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是___________________________________。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_______________。
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是_____________。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值 d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等 f.恒容时体系压强保持不变
(4)在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果,判断该反应的速率由大到小的顺序是__________________________(用编号填写)。
A.V(NH3)=0.5 mol •L-1-•min-1 B.V(H2)=0.3 mol •L-1-•min-1
C.V(N2)=0.2 mol •L-1-•min-1 D.V(H2)=0.01 mol •L-1-• s -1
-
工业合成氨反应:N2+3H2⇌2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可______(填“吸收”或“放出”)热量______kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是__________。
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是_______。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
工业合成氨反应:N2+3H2  2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可___(填“吸收”或“放出”)热量___kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_____mol/(L·min)。
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________
A.正反应速率和逆反应速率相等 B.正反应速率最大,逆反应速率为0
C.N2的转化率达到最大值 D.N2和H2的浓度相等
E.N2、H2和NH3的体积分数相等 F.反应达到最大限度
-
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么___________?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是________ mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大程度
(5)根据题目所给条件,判断影响该反应速率的因素有________、________、__________。
-
工业合成氨的反应:N2(g)+3H2(g)  2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N
2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N N键放出的能量分别为436KJ、391KJ、946KJ。则:
N键放出的能量分别为436KJ、391KJ、946KJ。则:
(1)若1mol N2完全反应生成NH3可______(填“吸收”或“放出)热量_____KJ。
(2)如果将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是_____________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是________mol·L -1·min-1。
(4)一定条件下,当成合成氨反应达到化学平衡时,下列说法正确的是(____)
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d. N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
工业合成氨反应:N2+3H2 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
工业合成氨反应:N2+3H2 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
工业合成氨的反应:N2+3H22NH3反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成2 mol NH3可________(填“吸收”或“放出”)热量________kJ。
0(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述(1)中的数值,其原因是________________________________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的恒容密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________(填字母代号)。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值
d.N2和H2的浓度相等
e.该条件下,反应达到最大限度
-
对于工业合成氨反应: N2 + 3H2  2NH3,下列说法错误的是
2NH3,下列说法错误的是
A、使用合适的催化剂可以加大反应速率
B、升高温度可以增大反应速率
C、增大N2浓度可以使H2转化率达到100℅
D、增大N2浓度可以增大反应速率
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2  2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______(填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
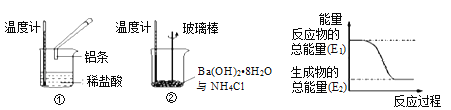
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程____(填“①”或“②”)的能量变化可用图表示。
(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
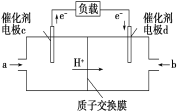
①则d电极是____(填“正极” 或“负极”),c电极的电极反应式为_____________________________。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______L。
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:

