-
钛酸钡被誉为“电子陶瓷工业的支柱”。工业制取方法如图,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],煅烧后可获得钛酸钡粉体。
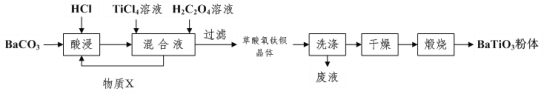
(1)酸浸时发生的反应的离子方程式为___。
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是___。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___。可循环使用的物质X是___(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:___。
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、___。
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要___mol•L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
-
钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。
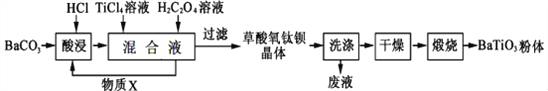
(1)酸浸时发生的反应的离子方程式为__________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_________________________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_______________________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_________;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
-
钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。
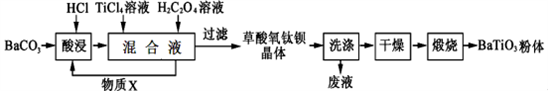
(1)酸浸时发生的反应的离子方程式为__________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_________________________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_______________________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_________;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
-
钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。
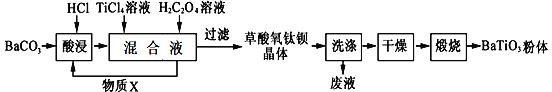
(1)酸浸时发生的反应的离子方程式为___________________________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为_____________________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:__________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_______;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知:常温下Ksp(BaSO4)=1.0×10-10, Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
-
(12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
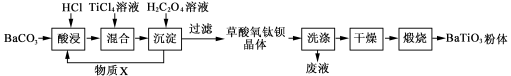
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
-
(12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
-
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
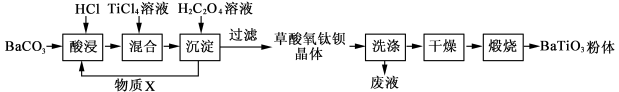
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式 ;可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
-
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
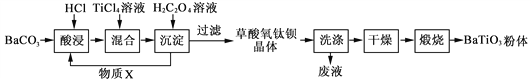
(1)酸浸时发生的反应的离子方程式为______________________________;为提高BaCO3的酸浸率,可采取的措施为___________________(任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是________________________。
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________________;
可循环使用的物质X是______。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、____和_____。
-
工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
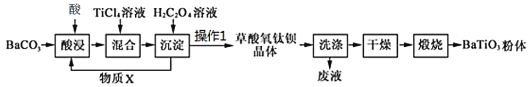
(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/ L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/ L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
-
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
| 元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
| Be | 4 | 89 | 9.32 |
| Mg | 12 | 136 | 7.644 |
| Ca | 20 | 174 | 6.111 |
| Sr | 38 | 191 | 5.692 |
| Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值∆r(Be-Mg)、∆r(Mg-Ca)明显大于∆r(Ca-Sr)、∆r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
| 名称 | 化学式 | 相对分子质量 | 熔点 |
| 草酸 | H2C2O4 | 90 | 101℃ |
| 液溴 | Br2 | 160 | -7.2℃ |
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)










