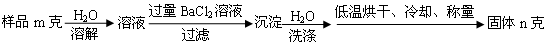-
氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g) 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
-
氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g) 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
-
氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
工业合成氨的化学方程式:N2 + 3H2 2NH3 +92.4KJ
2NH3 +92.4KJ
(1)它是氮的固定的一种,属于_____________( 选填“大气固氮”、“生物固氮” “人工固氮”);若升高温度,该平衡向____________方向移动(选填“正反应”或“逆反应”)。
(2)该反应达到平衡状态的标志是______________。(选填编号)
a.压强不变 b.v正(H2)= v正(NH3) c.c (N2)不变 d.c(NH3)= c(N2)
(3)欲使NH3产率增大,可采取的措施有_____________、____________。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则N2的平均反应速率为_________________________________________mol/(L∙S)。
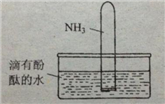
(4)如右图所示,将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,解释发生该现象的原因____________________________________。
(5)(NH4)2SO4是常用的氮肥,长期施用时会使土壤酸化板结,
用离子方程式表示原因___________________________________
检验(NH4)2SO4含NH4+的方法是_______________________________。
___________________________________________________.
-
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。
N2(g)+CO2(g) △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
-
氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l) 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g) 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
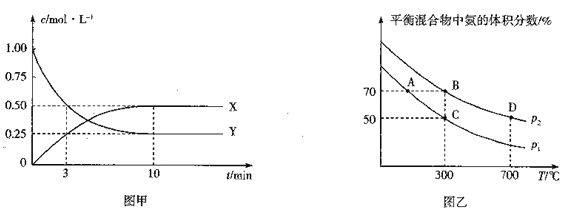
①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:
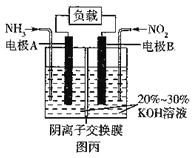
负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
-
氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l) 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g) 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
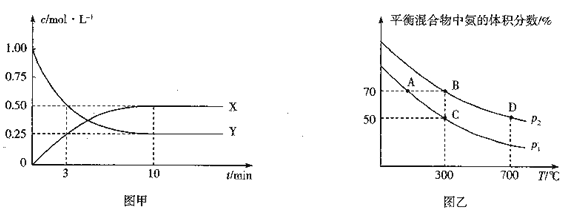
①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:
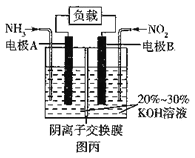
负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
-
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
-
(15分) [选修2—化学与技术]氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:
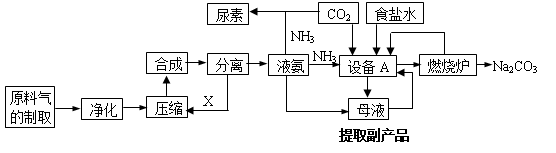
(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。

①检验沉淀是否洗涤干净的方法是_____________。
②样品中NaCl的质量分数的数学表达式为________________。
-
【化学选修2化学与技术】(15分)氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:
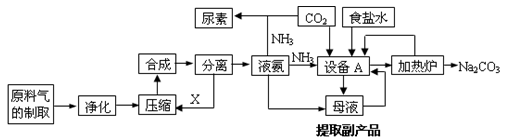
(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
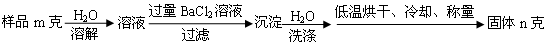
①检验沉淀是否洗涤干净的方法是_________________________________。
②样品中NaCl的质量分数的数学表达式为__________________________。
-
氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)  2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=_______mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)  2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
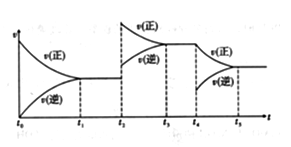
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2 :1,写出该反应的化学方程式:_________。标况下,每消耗1.12L氨气,转移_________mol电子。
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5Kj/mol; N2(g)+3H2(g)  2NH3(g)
2NH3(g)
ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_________。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。