-
室温下,用0.1 mol/L 的盐酸滴定相同浓度的25 mL溴化肼(N2H5Br)溶液,已知肼(N2H4)是二元弱碱,N2H4+H2O  N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O
N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O  N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )
N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )
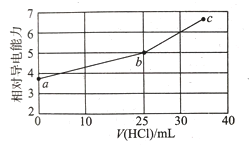
A.N2H4与硫酸反应形成的酸式盐的化学式为N2H6(HSO4)2
B.b点表示盐酸与溴化肼恰好完全反应:c(Cl-)=c(Br-)>c(N2H62+)
C.a点对应的溶液中:c(Br-)+c(OH-) ═ c(N2H5+)+2c(N2H62+)+c(H+)
D.c点的混合溶液中:c(Cl-)>c(Br-)>c(H+)>c(N2H62+)>c(N2H5+)>c(OH-)
-
室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是
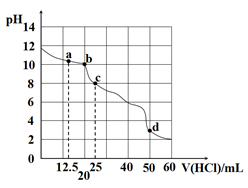
A.a点:c(A2-)=c(HA-)
B.b点:5c(Cl-)=4[c(A2-)+c(HA-)+c(H2A)]
C.c点:c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.d点:c(H+)=c(HA-)+c(A2-)+c(OH-)
-
室温下,用相同物质的量浓度的HC1溶液,分别滴定物质的量浓度均为0.1mol·L-1。的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是

A. 滴定时,随着盐酸溶液的滴入,水电离出的c(H+)始终增大
B. 滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,三种溶液中c(C1-)相等
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
-
已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2  B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+ B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
-
室温下,用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1的Na2SO3溶液,滴定曲线如图所示(不考虑滴定过程中SO2的逸出)。下列说法错误的是( )
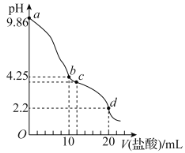
A.a点由水电离出的氢离子浓度大于d点由水电离出的氢离子浓度
B.0.05mol·L-1NaHSO3溶液的pH=4.25
C.c点时,c(Na+)>c(Cl-)>c(HSO )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.d点时,c(H2SO3)>c(HSO )>c(SO
)>c(SO )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
-
室温下,用相同浓度的KOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是( )
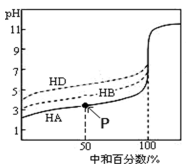
A. 滴定至P点时,溶液中:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
B. 当中和百分数达100%时,将三种溶液混合后: c(HA)+c(HB)+c(HD)-c(OH-)=c(H+)
C. 同浓度的KA、KB、KD三种盐溶液的pH大小关系:pH(KA) > pH(KB) > pH(KD)
D. 当三种酸都中和至中性时,消耗KOH溶液的体积的大小关系为:V(HA) < V(HB) < V(HD)
-
室温下,用0.1mol·L-1的NaOH溶液分别滴定相同浓度的弱酸HX、HY的稀溶液,其滴定曲线如图所示。下列说法错误的是( )
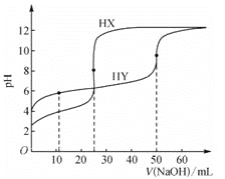
A.HX的酸性比HY的强 B.滴定过程中,均可用酚酞作指示剂
C.室温下,Ka(HY)的数量级约为10-4 D.滴定前,HY的体积为HX的两倍
-
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是
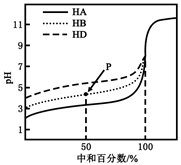
A. 三种酸的电离常数关系:KHA<KHB<KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
-
室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
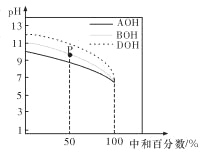
A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
-
室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
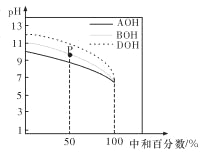
A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O
N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )









