-
氨气在科研、生产中有广泛应用。
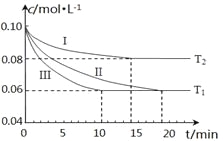
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=_________________________;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为_____________、__________________。
(2)常温下NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3•H2O的电离平衡常数K=______________________(保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3•H2O的电离平衡常数K=______________________(保留三位有效数字)。
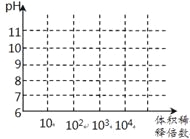
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线______________(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+______(g) ΔH2=__________________。
-
氨气在科研、生产中有广泛应用。
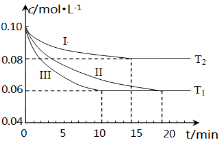
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)= ;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为 、 。
(2)常温下NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。
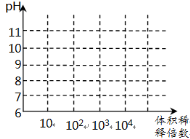
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
-
氨气在科研、生产中有广泛应用。在三个1 L的恒容密闭容器中,分别加入0.1 mol N2和0.3 mol H2发生反应N2(g)+3H2(g)  2NH3(g) ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如下图所示(T表示温度)。
2NH3(g) ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如下图所示(T表示温度)。
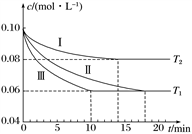
实验Ⅲ在前10分钟内N2的平均反应速率v(N2)=________(写出计算过程)。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g)
2NH3(g)  。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间
。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间 的变化如下图所示:
的变化如下图所示:
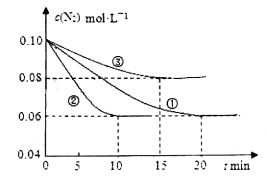
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L ,则该反应的平衡常数K=_______________;
,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
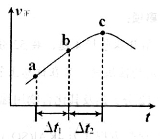
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C. 时,NO2的转化率:a~b段小于 b~c段
时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L 的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3
的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数
H2O的电离平衡常数 =___________。
=___________。
-
(14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
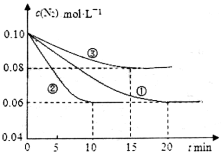
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
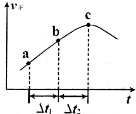
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
在l L密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的___________、_________(填字母编号)。
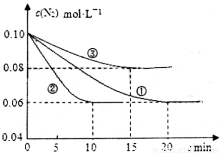
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_____________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
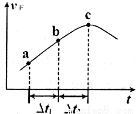
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将a mol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a__b。(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)⇌CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
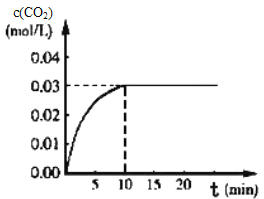
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)⇌Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
| 温度/℃ | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。
-
氨气是化工生产的主要原料之一,氨气的用途非常广泛。在一固定容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,发生如下反应: N2(g)+3H2(g) 2NH3(g)△H=-Q kJ/mol(Q>0)。
2NH3(g)△H=-Q kJ/mol(Q>0)。
(1)该反应所用的催化剂是_______(填写名称);该反应450℃时的平衡常数______500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是_______
A. 3v正(H2)=2v逆(NH3) B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2 mol计算从反应开始到平衡时,平均反应速率v(N2)为______________。
(4)在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,则产生的NH3的物质的量比原平衡产生的NH3______(填“多”或“少”或”“一样”)。
(5)工厂生产的氨水稀释后可作肥料。稀释氨水时,随着水的增加溶液中减少的是_______
a.  b.
b.  c.
c.  d.
d. 
(6)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:____。
-
化学反应原理在科研和生产中有广泛应用。CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)  CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 0.9 | 1.0 | 0.6 |
(1)反应达到平衡时,CO的转化率为________。
(2)该反应的平衡常数K=________。
(3)恒温恒容条件下,可以说明反应已达到平衡状态的是________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(4)若将容器体积压缩到1 L,则达到新平衡时c(H2)的取值范围是__________。
(5)若保持容器体积不变,再充入0.6 mol CO和0.4 mol CH3OH,此时v正__v逆(填“>”“<”或“=”),平衡_____________移动。
-
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01× Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示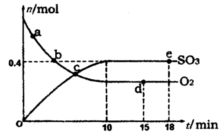 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO3-,SO32-离子的浓度由大到小的顺序是__________________。
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
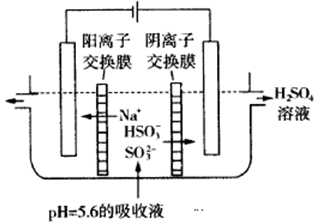
HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。


2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3•H2O的电离平衡常数K=______________________(保留三位有效数字)。






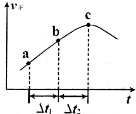

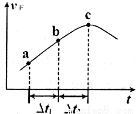

 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。