-
高纯碳酸锰在电子工业中有着重要的应用,湿法浸出软锰矿(主要成分为MnO2,含有少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的流程如下:其中除杂过程包括:①向浸出液中加入一定量的试剂X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Kap[Mg(OH)2]=1.8×10-11,Kap[Al(OH)3]=3.0×10-34,Kap[Fe(OH)3]=4.0×10-38。)
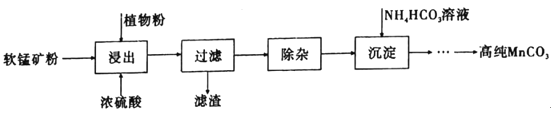
A.浸出时加入植物粉的作用是作为还原剂
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.试剂X可以是MnO、MnO2、MnCO3等物质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
-
高纯碳酸锰在电子工业中有着重要的应用,湿法浸出软锰矿(主要成分为MnO2,含有少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的流程如下:其中除杂过程包括:①向浸出液中加入一定量的试剂X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Kap[Mg(OH)2]=1.8×10-11,Kap[Al(OH)3]=3.0×10-34,Kap[Fe(OH)3]=4.0×10-38。)
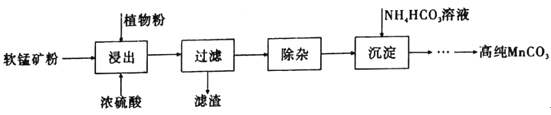
A.浸出时加入植物粉的作用是作为还原剂
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.试剂X可以是MnO、MnO2、MnCO3等物质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
-
(16分)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
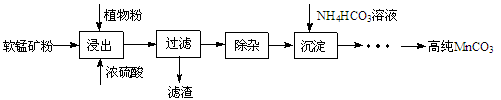
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO 3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
-
(16分)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
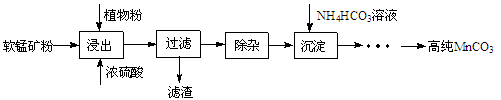
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO 3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
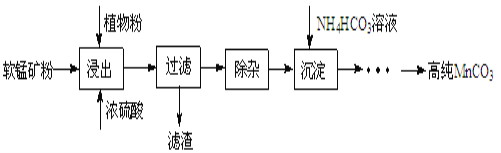
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时,植物粉的作用是_____。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_____;
操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____。
(3)制备:在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____;该反应的化学方程式为_____;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是_____。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。___________________
-
高纯MnCO3在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
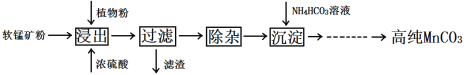
(1)浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是_________________,植物粉的作用是_________________。
(2)除杂过程的操作为:
①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是____________________________;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式___________。
(3)在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在 6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____________;该反应的化学方程式为________;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________________________。
(4)已知:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,当离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
____________
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)
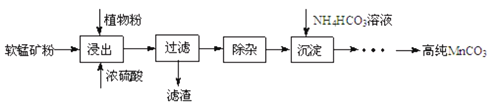
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.浸出时加入植物粉的作用是作为还原剂
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
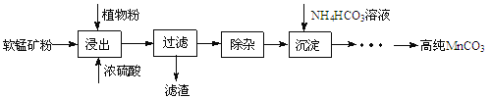
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.浸出时加入植物粉的作用是作为还原剂
C.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
-
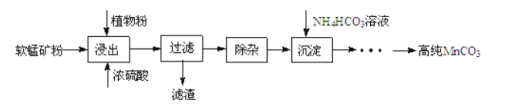
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为 ,含少量
,含少量 等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )已知室温下:
等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )已知室温下: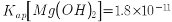 ,
,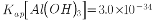 ,
,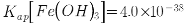 。)
。)
A.试剂X可以是 等物质
等物质
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去 等杂质
等杂质
C.浸出时加入植物粉的作用是作为还原剂
D.为提高沉淀 步骤的速率可以持续升高温度
步骤的速率可以持续升高温度
-
MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
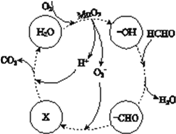
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。








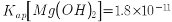 ,
,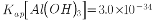 ,
,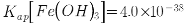 。)
。)
