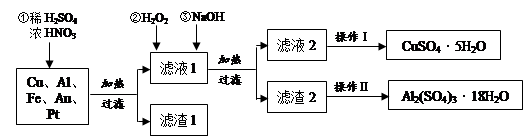-
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为 。
-
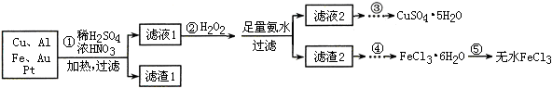
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为 。
-
信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 、
、 、
、 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
 第
第 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
 第
第 步加入
步加入 的作用是 ______ ,使用
的作用是 ______ ,使用 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
 由滤渣2制取
由滤渣2制取 ,探究小组设计了三种方案:
,探究小组设计了三种方案:
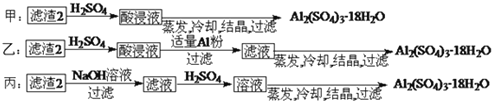
上述三种方案中, ______ 方案不可行,原因是 ______ ;
 探究小组用滴定法测定
探究小组用滴定法测定 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c 
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式 ______ .
______ .
-
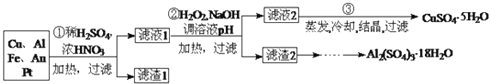
信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 、
、 、
、 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
 第
第 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
 第
第 步加入
步加入 的作用是 ______ ,使用
的作用是 ______ ,使用 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
 由滤渣2制取
由滤渣2制取 ,探究小组设计了三种方案:
,探究小组设计了三种方案:

上述三种方案中, ______ 方案不可行,原因是 ______ ;
 探究小组用滴定法测定
探究小组用滴定法测定 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c 
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式 ______ .
______ .
-
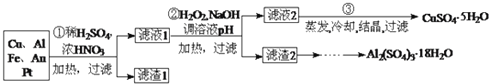
信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 、
、 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
 第①步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
第①步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
 第②步加入
第②步加入 的作用是 ______ ,使用
的作用是 ______ ,使用 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
 由滤渣2制取
由滤渣2制取 ,探究小组设计了三种方案:
,探究小组设计了三种方案:
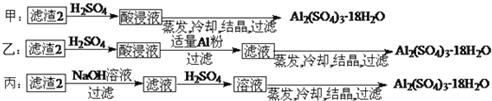
上述三种方案中, ______ 方案不可行,原因是 ______ ;
 探究小组用滴定法测定
探究小组用滴定法测定 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c 
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式 ______ .
______ .
-
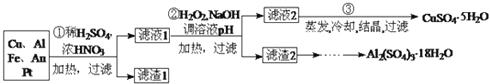
(14分)某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
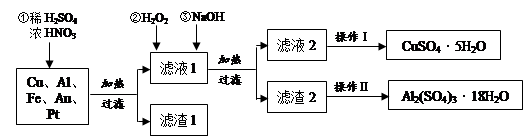
(1)在金属混合物与酸的反应中,表现氧化性的离子为________;得到滤渣1的主要成分为________。
(2)第②步加H2O2后发生反应的离子方程式为________;
通过加入NaOH调节溶液的pH,其目的是________;
(3)操作Ⅰ中包括的实验步骤有________、过滤;
(4)通过操作Ⅱ可以由滤渣2制取Al2(SO4)3·18H2O 。下列是操作Ⅱ的一种实验方案。

实验中:试剂1是________,试剂2是________。(填化学式)
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
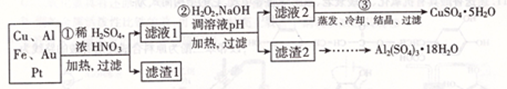
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe( OH)2 | Fe( OH)3 | Al( OH)3 | Cu( OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是________;
(2)某学生认为用H2O2代替浓HNO3更好,理由是;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是________。
(3)第②步中应将溶液pH调至________。
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:
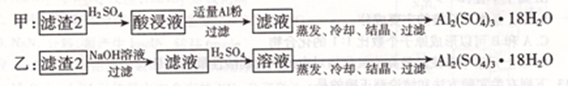
你认为________种方案为最佳方案,理由是________、________。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2 2S2O +I2= 2I-+S4O
+I2= 2I-+S4O
①样品中硫酸铜晶体的质量分数为____________。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是________。
-
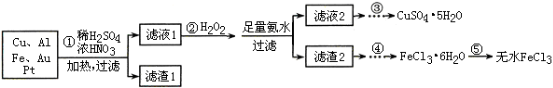
某研究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
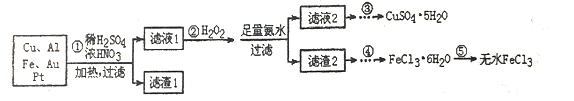
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为_________________________。
(2)步骤②加H2O2的作用是______________,滤渣2为(填化学式)__________。
(3)步骤⑤不能直接加热脱水的理由是________
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH=________(已知:Ksp[Cu(OH)2]=2.0x10-20)
(5)已知:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080mol·L-1Na2S2O3标准溶液滴定,达到滴定终点的依据是______________。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为__________。
-
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
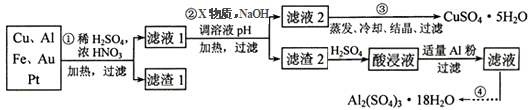
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
-
信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
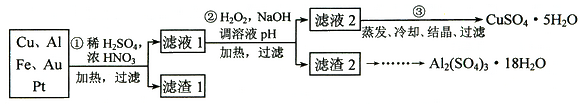
(1) 第①步Cu与酸反应的离子方程式为 。
(2) 第②步加H2O2的作用是 。
(3) 该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O ===2I-+S4O
===2I-+S4O ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 滴定过程中可选用________作指示剂,滴定终点的现象是____________。
② CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标
准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+。
③ 写出计算CuSO4·5H2O质量分数的表达式w=___________。
(4)请补充完整从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入_________至滤渣不再溶解,过滤, 在滤液中 、过滤、用水洗涤固体2-3次,在50℃下干燥,得到Al2(SO4)3·18H2O。(可选试剂有:硫酸溶液、氢氧化钠溶液、氨水、二氧化碳)